Анализ на мутацию генов
Содержание
Молекулярно-генетические маркеры для выбора тактики лечения и определения прогноза для пациентов с поставленным диагнозом
Мутации генов бывают генеративные (наследственные) и соматические. Последние возникают у человека на протяжении всей жизни и зависят от негативного влияния внешних факторов – стресса, вредных привычек, неправильного образа жизни.
Определить, какая мутация привела к образованию опухоли, поможет анализ крови и опухолевой ткани. ДНК-анализ крови позволяет выявить только наследственные мутации; ДНК-анализ опухолевой ткани позволяет выявить соматические мутации с определением их характера. ДНК-анализ опухолевой ткани необходимо проводить наравне с гистологией для диагностики и назначения терапии.
Соматические мутации у человека при онкологических заболеваниях
Лаборатории молекулярной генетики используют много разных методов для выявления генетических изменений, которые имеют терапевтическое значение при лечении рака. Так, для солидных опухолей (так обычно называют опухоли негемопоэтического происхождения) большинство тестов выполняется на образцах опухолевой ткани, зафиксированных парафином.
Основные типы исследований делятся на 3 класса:
- анализ ДНК;
- анализ экспрессии мРНК;
- анализ экспрессии белка.
Результаты каждого из тестов могут иметь различное клиническое значение, хотя все они могут анализировать одну и ту же мишень в опухолевой ткани.
Например, для рака легкого выявление мутаций в гене EGFR позволяет предсказывать чувствительность опухоли к ингибиторам тирозинкиназы EGFR, в то время как число копий ДНК EGFR, уровни экспрессии его мРНК или уровни соответствующего белка имеют небольшую или вовсе нулевую прогностическую ценность.
Где кодируются соматические мутации у человека
Генетическая информация передается от одной клетки к другой в форме дезоксирибонуклеиновой кислоты (ДНК). ДНК кодирует переносчик информации — рибонуклеиновую кислоту (мРНК), которая затем транскрибируется в белок. Строительные блоки ДНК включают четыре нуклеотида, включая аденозин (А), цитозин (С), гуанин (G) и тимидин (Т).
Строительными блоками белков являются аминокислоты, которых насчитывается 20. Геном человека состоит примерно из 3 миллиардов нуклеотидов. Из этих 3 миллиардов нуклеотидов только около 5% кодируют гены, которые транслируются в белки внутри клетки.
Далее ген делится на экзоны, которые содержат фактическую информацию, используемую при кодировании для синтеза белка, и интроны, которые представляют собой сегменты между экзонами, удаляющиеся до транслирования белка (интроны не содержат кодирующей информации).
Нуклеотиды организованы в трехбуквенные кодовые слова, называемые кодонами. Каждый кодон кодирует одну аминокислоту.Генетический код представляет собой полный набор из 64 трехбуквенных кодов, которые преобразуют кодоны в аминокислоты.
Примечательно, что генетический код вырожден; другими словами, поскольку имеется 64 кодона и только 20 аминокислот, более одного кодона могут кодировать одну и ту же аминокислоту.
Некоторые кодоны называются стоп-кодонами, потому что вместо кодирования аминокислоты они сообщают клетке, какая аминокислота является последней в белке. Мутации изменяют нормальную последовательность ДНК. Соматические мутации возникают при раке, но не обнаруживаются в соответствующих нормальных
тканях одного и того же пациента.
Разновидности мутации
Существует несколько видов мутаций, которые приводят к раковым образованиям:
- точечные;
- инсерции/делеции;
- амплификация генов (слияние);
- изменения мРНК;
- изменение структуры белков.
Точечные мутации (такие, как EGFR L858R при раке легкого) возникают в результате однонуклеотидных замен. Если эти мутации происходят внутри экзонов, они могут быть синонимичными (то есть кодированная аминокислота остается неизменной) или не синонимичными (то есть кодированная аминокислота изменяется).
Инсерции (такие, как вставки экзона 20 HER2 при раке легкого) и делеции (такие, как делеции экзона 19 EGFR при раке легкого) возникают, когда нуклеотиды вставляются или удаляются, соответственно, в кодирующих частях (экзонах) генома.
Области ДНК, которые кодируют гены, могут стать амплифицированными. Другими словами, вместо обычных 2 копий (по одной от каждого родителя) клетки приобретают больше копий (например, амплификация гена HER2 при раке молочной железы).
Участки ДНК могут также перестроиться: отрезки ДНК, которые обычно не соседствуют друг с другом, сливаются вместе (например, слияния генов EML4 и ALK при раке легких). Нормальные клетки должны иметь 2 копии гена-мишени.
Несколько копий предполагают амплификацию генов.
мРНК соответствующих генов могут присутствовать или отсутствовать при раке. Присутствие в большинстве случаев является сверхэкпрессированным, т.е. присутствует на более высоких уровнях. Мутации также могут быть обнаружены с использованием анализа мРНК.
Но, поскольку мРНК гораздо менее стабильны по сравнению с ДНК, они часто оказываются слишком сильно фрагментированными для анализа в клинических образцах. Таким образом, для обнаружения мутаций легче использовать ДНК.
Единственным исключением является то, что известные слияния генов легче обнаруживается на уровне мРНК.
Специфические белки при раке могут отсутствовать или присутствовать. Когда они присутствуют, они так же как и мРНК, могут быть «сверхэкспрессированы» (иметь более высокие уровни, чем обычно).
Однако показатели белка могут быть или не быть клинически значимыми.
Например, при раке легких мутации ДНК EGFR, но не уровни белка EGFR по IHC, предсказывают чувствительность к ингибиторам тирозинкиназы EGFR.
Где провести анализ на мутацию генов при онкологии
Центр Инновационных Биотехнологий Аллель предлагает широкий спектр молекулярно-генетических исследований, направленных на выявление соматических изменений в ДНК при раковых заболеваниях.
Заполните форму на сайте или позвоните нам по номеру: +7 (495) 780-92-96, чтобы узнать подробнее, как проводится исследование, уточнить стоимость и сроки проведения анализов.
Источник: https://AllelTech.com/shop/catalog/onkogenetika/vyyavlenie-somaticheskikh-mutatsiy-v-obraztsakh-opukholevoy-tkani-parafinovye-bloki-gistologicheskie/
Мутация генов гемостаза: проявления и последствия

Гемостаз является системой организма, отвечающей за нормальную остановку кровотечения, а также свертываемость крови. Правильное функционирование гемостаза напрямую зависит от состояния стенок сосудов, равно как и от количества тромбоцитов, находящихся в крови, и ряда прочих факторов.
Чем это опасно?
Различные варианты мутации генов гемостаза способны приводить к всевозможным патологиям в развитии плода, которые связаны с нарушениями свертываемости крови. Они считаются причиной хронической неспособности вынашивания плода, что проявляется в выкидышах на поздних сроках либо в виде иных негативных последствий. По этой причине важно своевременно проходить обследование.
Когда пациентам требуется проведение обследования на мутации генов гемостаза?
Процесс мутации (полиморфизм) служит достаточно распространенным явлением, в связи с чем анализы требуется сдавать в ряде нескольких случаев.
- Когда женщине подбирают оптимальный вариант гормональной контрацепции, либо она проходит курс заместительной гормональной терапии.
В этой ситуации проведение проверки даст возможность выбрать наиболее безопасный метод, чтобы не навредить способности женщины к зачатию в будущем. Когда еще нужно сдать кровь на мутации генов гемостаза?
- В том случае, если пациентка обратилась к лечащему врачу по поводу своего бесплодия либо хронической неспособности вынашивания плода.
О наличии мутаций генов гемостаза, как правило, свидетельствуют многократные неудачные попытки экстракорпорального оплодотворения наряду с поздними токсикозами, задержками развития плода и прочей симптоматикой. Даже уже одного из перечисленных признаков будет достаточно для того, чтобы провести соответствующее обследование.
- Обследование назначается и в том случае, когда у женщины были зафиксированы случаи тромбозов в возрасте до пятидесяти лет.
В особенности это имеет отношение к курящим пациентам, среди близких родственников которых могли наблюдаться случаи возникновения тромбозов глубоких вен, а также инсульты и инфаркты миокарда.
Что рекомендуют врачи?
Сдать все необходимые анализы на мутации генов гемостаза доктора советуют непосредственно перед плановой хирургической операцией, например трансплантацией либо эндоскопическим протезированием и так далее.
Патология свертываемости крови в результате серьезного вмешательства способна вызвать грозные осложнения вплоть до гибели больного. Кроме того, обследование следует провести в том случае, если у молодого человека имеются нарушения слуха, определить причину которых не получается.
Все вышеперечисленные ситуации являются основными случаями, когда может потребоваться проверка на наличие заболеваний.
Разные мутации генов гемостаза могут также оставаться незаметными для пациентов в течение многих лет, так как способны протекать без каких-либо симптомов, а возникать внезапно.
Правда, в стрессовый для организма момент, к примеру, во время беременности либо на фоне хирургического вмешательства, могут обнаруживаться нарушения свертываемости крови, которые способны приводить к гибели плода, а также к иным опасным последствиям.
Основные причины формирования мутаций
Мутации генов системы гемостаза бывают врожденными, которые передаются поколениями по нисходящей линии. Ввиду такой опасности, обязательно требуется прохождение проверки, особенно в том случае, если появление тромбозов и несвертываемости крови было замечено среди близких родственников. Правда, существуют и приобретенные мутации, возникающие под влиянием различных факторов.
Одной из основных причин выступает так называемый антифосфолипидный синдром, являющийся аутоиммунным заболеванием, на фоне которого в организме человека вырабатываются антитела по отношению к собственным фосфолипидам. Аутоиммунные патологии, как правило, возникают нечасто, правда, мутации гемостаза способны формироваться и по иным причинам.
Это регулярные стрессовые ситуации, снижающие сопротивляемость организма различным инфекциям. Помимо этого, во время постоянного перенапряжения могут нарушаться различные функции в деятельности организма.
Наличие онкологических либо эндокринных заболеваний. Отчасти таковые бывают связанными с экологической обстановкой. Уже доказано, что в некоторых районах раковые опухоли наряду с всевозможными генными мутациями встречаются намного чаще ввиду загрязнения окружающей среды из-за деятельности человека.Прием фармацевтических препаратов, в особенности гормональных. Обследование требуется осуществлять перед применением гормональных контрацептивов в целях избегания их отрицательного и достаточно опасного влияния на организм человека.
Дополнительная группа риска
Факторов, влияющих на возникновение мутации генов гемостаза, довольно много. В дополнительной группе риска, помимо всего прочего, могут оказаться люди, страдающие выраженным ожирением, на фоне чего к появлению генных мутаций могут привести некоторые типы травм.
На данный момент точно не известно, на основании какого принципа возникают мутации генов, правда сейчас мировая медицина научилась минимизировать последствия данного полиморфизма.
При первом появлении подозрений требуется сдача анализов, причем делать это следует еще на этапе планирования женщиной беременности.
Гены гемостаза, наиболее часто подверженные мутации
Во время обращения в клинику пациентам предлагают пройти обширное обследование. Таким образом, непосредственно анализ на мутации генов гемостаза проводят в отношении:
- Гена протромбинов. Мутации этого вида выражаются в виде врожденных тромбофилий, на почве чего вероятны тромбозы сосудов, а, кроме того, значительно возрастает риск инфарктов и инсультов. Употребление контрацептивных лекарственных изделий способно в несколько раз повысить риск формирования тромбов. Среди беременных женщин мутация данного гена выражается неспособностью выносить плод, а также вероятна отслойка плаценты и задержка развития эмбриона.
- Следующий тип – это мутация Лейдена, которая проявляется изменениями гена пятого фактора. Симптоматика в данном случае аналогична предыдущему варианту. Также для этого типа мутации свойственна гибель плода, как правило, в течение второго, максимум третьего триместра.
- Мутации генов фибриногена проявляются в виде тромбозов глубоких вен, а также тромбоэмболии в том числе. В данном случае вероятно невынашивание плода и, как следствие, выкидыши на ранних и более поздних сроках.
- Мутации генов метаболизма фолиевой кислоты могут приводить к порокам в развитии нервной системы у вынашиваемого плода. Не исключены патологии сосудов, сердца и урогенитального аппарата. Анализ крови на мутации генов гемостаза необходимо проходить всем женщинам, которые планируют беременность, особенно тем, кто находится в группе риска.
- В том случае, если в гене метаболизма фолиевой кислоты возникают мутации, то это приводит к нарушению работы фермента метилентетрагидрофолатредуктаза, который преобразует вещество гомоцистеин в метионин. В ситуациях, когда врачи наблюдают у пациенток подобный процесс, почти в два раза возрастает риск появления атеросклероза, а кроме того, увеличивается возможность появления на свет ребенка с серьезными отклонениями нервной системы. У таких детей может, плюс ко всему, наблюдаться анэнцефалия наряду с глубокой умственной отсталостью и прочими вариантами поражения.
- В случае с геном гликопротеина мутации сопровождаются тромбозами, а также тромбоэмболиями, из-за чего значительно повышается риск возникновения инсультов и инфарктов миокарда в молодом возрасте. Мутационные изменения могут передаваться по наследству, по этой причине данный фактор следует обязательно учитывать во время планирования беременности, особенно в том случае, если уже имелись ранее выкидыши.
- Мутации гена, который отвечает за ингибитор активатора плазминогена, могут послужить причиной выкидышей как на ранних, так и на более поздних сроках. Кроме того, это вызывает гестозы, отслойку плаценты и прочие негативные последствия. Своевременное установление подобной мутации дает возможность снизить риск их проявления во время беременности и родов.
Существуют также некоторые гены, чье состояние подлежит анализу в ходе исследования.
В зависимости от полученных результатов супружеская пара сможет решить, стоит ли вообще планировать ребенка, ведь при наличии вероятных патологий опасность осложнений велика.
Подобное решение дается всегда нелегко, но необходимо трезво оценить уровень риска, а кроме того, принимать обдуманное и взвешенное решение.
Сейчас анализ на мутации генов гемостаза в «Инвитро» можно провести. Это быстро и недорого.
Каким образом происходит исследование генов гемостаза?
Работоспособность системы гемостаза можно анализировать несколькими методами. В роли материала для анализа используют капиллярную или венозную кровь, а образцы сдавать необходимо натощак.
Будет лучше всего заранее уточнить график работы лаборатории, воздержавшись при этом от употребления острой либо соленой еды накануне. Это требуется, для того чтобы не произошло искажения результатов анализов.
Как еще можно сдать анализ на мутации генов гемостаза?
Иной способ получения материалов
На сегодняшний день имеется еще один способ получения материалов в целях проведения анализа. Таким образом, в некоторых клиниках используют защечный мазок, который позволяет получить клетки эпителия, находящиеся с обратной стороны щек. Подобный метод служит абсолютно безболезненным и довольно быстрым вариантом.
Такая мера является возможностью провести обследование без лишнего дискомфорта, особенно для тех, кто боится уколов. По завершении проведения лабораторных анализов врачи назначают консультацию специалиста-гематолога, который должен будет подробно объяснить и прокомментировать полученные результаты.
Данный анализ проводят методом полимеразной цепной реакции, определение результата становится возможным благодаря контрольным образцам.
Мутация генов гемостаза и беременность
В рамках проведения лабораторных исследований учитывают тот факт, что в период беременности, как правило, незначительно возрастает уровень свертываемости крови, что вовсе не является патологией.
Правда, наличие мутаций способно усиливать такой процесс, а начавшиеся тромбозы могут причинять большой вред матери и будущему ребенка.
Что выявляет обследование на мутации генов системы гемостаза?
Определение генетики
Для того чтобы установить, передается ли это по наследству, рекомендуют сдать анализы на определение генетики. Столь недешевая процедура поможет выяснить вероятность возможных отклонений в системе гемостаза у будущего потомства.
Данный тип анализов назначают пациентам, в чьем роду уже были случаи тромбоза.
Бить тревогу обязательно стоит, так как не выясненная вовремя мутация может привести к гибели плода либо к тяжелым порокам в его умственном и физическом развитии.
Расшифровку мутации генов гемостаза должен проводить высококвалифицированный специалист.
Можно ли проводить коррекцию нарушений?
На подобный вопрос медицина отвечает положительно, так как благодаря современным методам можно бороться с повышенной свертываемостью крови, а также предотвращать плацентарную недостаточность.
Для этого назначают фолиевую кислоту, которая препятствует образованию тромбов, а также врачами прописываются специальные поливитамины и прочие необходимые препараты.
В том случае, если точно соблюдаются врачебные рекомендации, шанс вынашивания здорового ребенка наряду с успешными родами без осложнений возрастает до девяноста пяти процентов.
Заключение
Установление тех или иных нарушений в работе системы гемостаза не считается приговором для больного. Существуют специальные лекарственные средства, которые способны предупреждать возникновение тромбозов и минимизировать последствия различных хромосомных отклонений у будущего ребенка.
Даже в том случае, если у женщины несколько раз не получалось выносить плод, после начала грамотного лечения есть вероятность значительно повысить шансы на успех.
Таким образом, успехи лабораторных методик исследования позволяют на сегодняшний день получать максимально достоверную информацию о правильном наборе хромосом, а также о возможных отклонениях.
Источник: https://FB.ru/article/353213/mutatsiya-genov-gemostaza-proyavleniya-i-posledstviya
Мутации генов гемостаза MTHFR – что это значит и что с этим делать
Мутация гена MTHFR является проблемой, связанной с плохим метилированием и продукцией ферментов. Мутации генов гемостаза MTHFR влияют на каждого человека по-разному. Иногда они приводят к едва заметным симптомам, а иногда приводят к серьезным, долговременным проблемам со здоровьем.
Хотя точный показатель распространенности все еще остается предметом дискуссий, считается, что 30%-50% всех людей могут иметь мутацию в гене MTHFR, который наследуется и передается от родителя к ребенку.
Как правило, это гетерозиготная мутация. Приблизительно от 14% до 20% процентов населения могут иметь более тяжелую мутацию MTHFR, которая более резко влияет на общее состояние здоровья.
Она называется гомозиготной мутацией.
Разница состоит в том, что гетерозигота – это мутация в одной аллели пары генов. То есть шанс ее проявления составляет 50%. А гомозигота – мутация в обеих аллелях пары генов, проявление в 100% случаев.
Мутация гена MTHFR была обнаружена во время завершения проекта генома человека. Исследователи поняли, что люди с этим типом наследственной мутации имели большую вероятность развития определенных заболеваний. К ним относятся: СДВГ, болезнь Альцгеймера, атеросклероз, аутоиммунные расстройства и аутизм.
Еще многое предстоит узнать о том, что означает этот тип мутации для людей, которые несут ее и продолжают передавать своим детям.
На сегодняшний день существуют десятки различных состояний здоровья, связанных с мутациями MTHFR. Но еще раз подчеркнем, что даже если вы являетесь носителем мутации – не факт, что у вас будут ее проявления. Мутация означает лишь повышение рисков.
Что такое мутация генов MTHFR
MTHFR — это ген, который обеспечивает организм инструкциями по производству определенного фермента, называемого метилентетрагидрофолатредуктаза . То есть MTHFR — сокращенное название этого фермента.
Есть две основные мутации MTHFR, на которых исследователи фокусируются чаще всего. Эти мутации часто называют «полиморфизмами» и влияют на гены, называемые MTHFR C677T и MTHFR A1298C.
Также эти мутации называют – мутациями фолатного цикла, потому что они показывают, как организм преобразует фолиевую кислоту в активную форму для наилучшего усвоения.
Соответственно, если у вас есть мутации генов гемостаза MTHFR, то ваш организм плохо усваивает фолиевую кислоту и другие витамины группы B, особенно В12. Что делать в этом случае – читайте далее.Мутации могут происходить в разных местах этих генов и наследоваться только от одного или обоих родителей. Наличие одного мутантного аллеля связано с повышенным риском определенных проблем со здоровьем, но наличие двух увеличивает риск намного больше.
Мутация гена MTHFR может изменить способ, которым некоторые люди метаболизируют и преобразовывают важные питательные вещества из своего рациона в активные витамины, минералы и белки.
Генетические мутации также могут изменять уровни нейротрансмиттеров и гормонов.
В некоторых случаях, хотя и не во всех, изменения в работе этого фермента могут влиять на параметры здоровья, включая уровень холестерина, функцию мозга, пищеварение, эндокринные функции и многое другое.
Часть о мутациях генов гемостаза MTHFR впервые узнают после анализа причин замершей беременности
1. Потребляйте больше натурального фолата, витамина В6 и витамина В12
В случае с мутациями генов фолатного цикла важно употреблять много продуктов, богатых витаминами B6, B9 и B12.
Вы также можете принимать их в виде добавки. Однако, помните, что людям с мутациями MTHFR труднее переводить синтетическую форму фолиевой кислоты в биодоступную. Более того, прием обычной фолиевой кислоты может вызвать ухудшение симптомов.
Получение достаточного количества фолиевой кислоты особенно важно до и во время беременности. За три месяца до зачатия и в течение первого триместра беременности матери, которые получают достаточно фолиевой кислоты, снижают риск развития у детей различных проблем со здоровьем.
Людям с мутациями MTHFR критически важно получать биодоступные формы фолата в добавках, называемых L-метилфолатом или метильной формой витамина В9.
L-метилфолат сложнее упаковывать в форме капсул, поэтому вы, возможно, не сможете получать очень высокие дозы в типичных поливитаминах или добавках. Поэтому рекомендуется принимать моно-добавки под называнием 5-MTHF.
Now Foods, Метилфолат, 5000 мкг, 50 вегетарианских капсул
Thorne Research, 5-МТГФ, 5 мг, 60 капсул
Если у вас обнаружена мутация MTHFR в форме гомозиготы, то метильные комплексы фолиевой кислоты вам необходимо пропивать постоянно курсами — минимум 3 раза в год.
Наличие большего количества фолиевой кислоты в вашем рационе означает, что вы лучше способны создавать активную форму 5-MTHF. Некоторые из лучших продуктов с высоким содержанием фолиевой кислоты включают в себя:
- Фасоль и чечевица
- Листовые зеленые овощи, такие как сырой шпинат
- Спаржа
- Ромэн
- Брокколи
- Авокадо
- Яркие фрукты, такие как апельсины и манго
Источник: https://blisswoman.ru/shemy/mutatsii-genov-gemostaza-mthfr-chto-eto-znachit-i-chto-delat/
Мутации генов гемостаза: причины возникновения и коррекция

Гемостаз — одна из важнейших систем организма, которая отвечает за нормальную свертываемость крови и остановку кровотечений. Правильное функционирование этой системы определяет здоровое состояние кровеносных сосудов, сохранение жидкого состояния крови.
В то же время мутации гемостаза могут привести к различным серьезным патологиям, например, развитию тромбозов, сердечно-сосудистых заболеваний, невынашиванию беременности.
О причинах возникновения мутаций и способах их коррекции Medical Note рассказала гемостазиолог Седа Майрабековна Баймурадова — научный руководитель Научного центра гемостаза, тромбоза и фетальной медицины, врач акушер-гинеколог, доктор медицинских наук.
Седа Майрабековна, какие мутации генов гемостаза выделяют в медицине и каковы причины их возникновения?
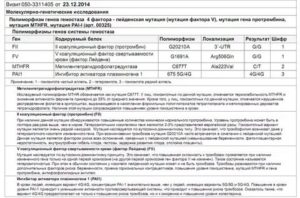
— В настоящее время к мутациям генов гемостаза относятся мутация FVLeiden, FIIG20210A, дефицит протеина С, дефицит протеина S.
Что же касается причин их возникновения, то отмечу, что мутации генов гемостаза связаны главным образом с наследственным фактором, то есть мы рождаемся с этими генами или полиморфизмами, это то, что мы получили по наследству от своих родителей, они с нами с рождения.
Возможно, природа появления этих мутаций компенсаторная — возмещающая. Кровотечение сопровождает рождение человека, и должен быть механизм внутри человека, который остановит это кровотечение.
Но в ряде случаев тромбофилия (состояние организма, характеризующееся повышенным тромбообразованием) работает как причина серьезных осложнений со здоровьем.
Какие гены гемостаза наиболее часто подвержены мутациям?
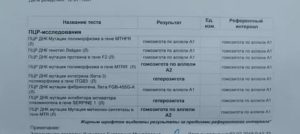
— У каждого четвертого человека в популяции может быть та или иная мутация генов тромбофилии, например, «675 4G/5G» в гене ингибитора активатора плазминогена 1-типа PAI-1, полиморфизм «163G/Т» в гене A-субъединицы фактора XIII, «I/D» в гене тканевого активатора плазминогена, «-455G/A» в гене фибриногена β-субъединицы, «1565 Т/С» в гене гликопротеина Gp-IIIa тромбоцитов, MTHFRC677T.
В чем опасность мутаций гемостаза?
— Наличие мутаций гемостаза является фактором риска внезапных осложнений — тромбозов, инфарктов, инсультов.
У женщин в период беременности мутации гемостаза также могут привести к невынашиванию и угрозе невынашивания, гестозам, способствовать бесплодию.
Кроме того, генетическая предрасположенность к тромбофилии может приводить к возникновению сердечно-сосудистых заболеваний (АГ, атеросклероз, мерцательная аритмия).
В каких случаях необходимо обследование на мутации генов гемостаза?
— Обследование на мутации генов гемостаза показано в следующих случаях:
- при наличии тромбоза, инфаркта или инсульта в анамнезе, если в роду у пациента есть родственники с такими заболеваниями;
- при невынашивании, отягощенном течении беременности (угроза прерывания, гестоз, ПОНРП — преждевременная отслойка нормально расположенной плаценты);
- при бесплодии и неудачах ЭКО.
Возможна ли коррекция мутаций гемостаза во время беременности?
— Да, при условии, что мы знаем, какие мутации и в каких сочетаниях выявлены у пациенток.
Коррекция влияния тромбофилии на организм пациентки возможна двумя способами.
Первый — это традиционное лечение при наличии проблем со здоровьем. Здесь мы назначаем лечение, ориентируясь на результаты анализов и имеющиеся жалобы.
Второй способ — профилактический: на основании только результатов анализов.
Расскажите, пожалуйста, о диагностике и способах коррекции мутаций гемостаза
— Анализ на мутации тромбофилии сдается один раз в жизни, и его результаты не меняются. Соблюдения специальных условий перед сдачей анализа нет, то есть можно сдать кровь на наследственную тромбофилию в течение дня независимо от того, поел пациент или нет.
Обследование помимо стандартной диспансеризации (общий анализ крови и мочи, ЭКГ) должно включать скрининг анализ крови на определение состояния кровотоков-гемостазиограмма +ДДимер, АТ 3, Парус-тест. Этот анализ поможет своевременно выявить скрытую угрозу здоровью пациента и предупредить вышеописанные осложнения.
Вообще, нет единого протокола лечения мутаций тромбофилий.
Принципиально надо понимать, что нельзя лечить результаты анализов. Врач оценивает в первую очередь жалобы пациента, во вторую — результаты обследования. Лечение направлено главным образом на улучшение кровообращения.
Способы лечения тромбофилии разные. Это здоровый образ жизни, правильное питание, прием лекарственных препаратов, применение в некоторых случаях гирудотерапии (оздоровление организма и лечение пиявками), здоровый сон.
Замечу, что наибольший оздоровительный эффект приносит терапия, подобранная индивидуально для каждого пациента.Лечение может быть курсовое или постоянное в зависимости от причины обследования или жалоб пациента.
Источник: https://zen.yandex.ru/media/blog.mednote.life/mutacii-genov-gemostaza-prichiny-vozniknoveniia-i-korrekciia-5e4262e1f248266529650905
BRCA мутация гена: анализ BRCA 1 и BRCA 2 на мутацию цена в Москве в Европейской клинике

Аббревиатурой BRCA обозначают два гена — BRCA1 и BRCA2. С английского языка их название переводится как «ген рака молочной железы» (BReast CAncer gene).
Несмотря на такое название, гены BRCA1 и BRCA2 сами по себе не приводят к раку. Они есть в клетках любого здорового человека и выполняют важные функции. Риск злокачественной опухоли повышается, когда функция этих генов нарушается из-за мутаций.
В норме белки, которые кодируют эти гены, нужны, чтобы восстанавливать поврежденную ДНК. Если в них возникают дефекты, то эта функция нарушается, поврежденная ДНК не восстанавливается должным образом, в клетке накапливаются генетические поломки, и она может превратиться в раковую.
По статистике, мутации в генах BRCA1 и BRCA2 встречаются у одного из 300–800 людей.
У носителей повышен риск рака молочной железы, яичников, фаллопиевых труб, брюшины, предстательной железы, поджелудочной железы, желудка, желчного пузыря и желчных протоков, меланомы.
Если человек наследует некоторые мутации от обоих родителей, у него развивается анемия Фанкони, повышается риск развития некоторых злокачественных опухолей и острого миелоидного лейкоза.
Какие функции выполняют гены BRCA1 и BRCA2 в норме?
Гены BRCA1 и BRCA2 находятся в разных хромосомах — соответственно в длинном плече (q) хромосомы 17 в положении 21.31 и в длинном плече (q) хромосомы 13 в положении 13.1. Но они выполняют схожие функции.
Расположение гена BRCA1. Источник: https://ghr.nlm.nih.gov/gene/BRCA1#location
Расположение гена BRCA2. Источник: https://ghr.nlm.nih.gov/gene/BRCA2#location
Оба белка, которые кодируются этими генами, устраняют двунитевые разрывы ДНК посредством гомологичной рекомбинации. Все хромосомы в клетках человека парные. Когда в одной из хромосом повреждены обе нити ДНК, сестринская хромосома «жертвует» ей одну цепочку аналогичного фрагмента своей ДНК, и по ней, как по шаблону, восстанавливается вторая цепочка.
Гены BRCA играют важную роль в этом процессе. Они являются генами-супрессорами опухолей. Если в них происходят мутации, геном становится нестабильным. Из-за накопившихся генетических дефектов нормальная клетка превращается в опухолевую и дает начало злокачественному новообразованию.
Как происходит мутация, и чем это грозит?
Все мутации в генах делят на две большие группы:
- Наследственные (герминальные) человек получает от родителей. Например, если у матери или у отца есть дефект в гене BRCA1 или BRCA2, ребенок получит его с вероятностью 50%, и он будет присутствовать во всех клетках тела. Мутация BRCA наследуется по аутосомно-доминантному типу, то есть достаточно, чтобы она присутствовала только в одной из парных хромосом. Даже если второй ген будет нормальным, функция белка нарушается, и это грозит повышенным риском рака.
- Соматические мутации возникают в течение жизни, например, из-за воздействия на организм ионизирующих излучений, химических канцерогенов. В этом случае генетический дефект возникнет только в некоторых клетках. И это тоже может привести к раку.
На данный момент известно множество разных видов мутаций в генах BRCA. Это могут быть делеции (потеря участка хромосомы), инсерции (лишние вставки в ДНК), однонуклеотидные полиморфизмы (замена отдельных «букв» генетического кода).
Насколько сильно повышается риск рака?
Рак молочной железы — самая распространенная «женская» злокачественная опухоль. По данным экспертов из США, это заболевание будет диагностировано в течение жизни у каждой восьмой женщины. У мужчин такая опухоль тоже может возникнуть, но риск намного ниже — 0,1% в течение жизни. При нарушенной функции генов BRCA риски существенно повышены.
При мутациях в BRCA1:
- Риск развития рака молочной железы у женщин к 70 годам: 44–78%.
- Риск развития рака молочной железы у мужчин к 70 годам: 0,22–2,8%.
При мутациях в BRCA2:
- Риск развития рака молочной железы у женщин к 70 годам: 31–56%.
- Риск развития рака молочной железы у мужчин к 70 годам: 3,2–12%.
Рак молочной железы, связанный с наследственными мутациями, составляет 5–10% от всех случаев. В 35% случаев за его развитие ответственны дефекты в гене BRCA1, в 25% случаев — в гене BRCA2.
Риск заболеть раком яичников в течение жизни для среднестатистической женщины составляет около 1,3%. При мутациях в гене BRCA1 он повышается до 18–54%, в гене BRCA2 — до 2,4–19%.
Кому нужно провериться на мутации BRCA?
Консультация клинического генетика и анализы на мутации в генах BRCA показаны в следующих случаях:
- Рак молочной железы у женщины выявлен в возрасте младше 50 лет.
- Злокачественные опухоли в обеих молочных железах.
- Трижды негативный рак молочной железы: по данным иммуногистохимического исследования, на поверхности опухолевых клеток отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2.
- Медуллярный рак молочной железы — редкий гистологический тип опухоли, по статистике часто бывает связан с мутациями.
- Первично-множественные злокачественные новообразования (ПМЗН) — когда у пациента диагностируют сразу две или более разных злокачественных опухолей. Чаще всего речь идет о раке молочной железы и яичников.
- Рак яичников, маточных труб, поражение злокачественными клетками брюшины в любом возрасте.
- Рак молочной железы у мужчины.
- Мутации в генах BRCA1 и BRCA2 особенно распространены в этнической группе евреев ашкенази, им рекомендуется провериться, даже когда нет других факторов риска.
Также рекомендуется проверяться людям, у которых отягощен семейный анамнез: если рак молочной железы был диагностирован у близкой родственницы до 50 лет, рак яичников в любом возрасте, двусторонние опухоли в молочной железе, первично-множественные злокачественные опухоли, если рак молочной железы диагностирован в любом возрасте у двух близких родственниц, у родственника-мужчины.
Наследование мутаций в генах BRCA. Розовым обозначены нормальные участки хромосом, белая — участок с мутацией. В данном случае носителем является отец, он передал «неправильный» ген одному из сыновей и одной из дочерей (50%). Двум другим детям (50%) достались нормальные гены. Источник
Если есть эти факторы риска, сначала логично проверить на мутации BRCA члена семьи, у которого был диагностирован рак. Затем проводят анализы на обнаруженные мутации у его близких родственников. Детям до 18 лет эти исследования не обязательны, потому что эффективных мер профилактики в детском возрасте не существует.
Зная о наличии мутации BRCA у онкологического больного, врач может назначить более эффективное лечение, правильно оценить прогноз. У здоровых людей эта информация помогает своевременно принять некоторые меры профилактики.
Как выявить мутации BRCA?
Для этого существуют специальные анализы. На исследование можно отправить образец крови (так называемая жидкая биопсия) или фрагмент злокачественной опухоли.
В крови можно обнаружить только наследственные мутации. Анализ опухолевой ткани позволяет выявить соматические мутации, которые произошли непосредственно в раковых клетках.
Поэтому зачастую рекомендуется отправлять в лабораторию и образец крови, и фрагмент ткани.
Мутации выявляют разными способами, наиболее современный — метод секвенирования следующего поколения (Next-Generation Sequencing, NGS). Он позволяет выявить максимум разных генетических дефектов. Европейская клиника сотрудничает с ведущими зарубежными лабораториями, которые проводят такие исследования.
Что означает результат?
Если из лаборатории пришел положительный результат, это означает, что в опухолевых клетках есть мутация BRCA.
Если результат отрицательный, это еще не означает, что гены в клетке работают абсолютно нормально. Во-первых, мутации BRCA бывают очень разными.
Большинство из них можно выявить, но некоторые редкие не изучены, и анализы их не обнаруживают.
Во-вторых, даже если гены BRCA1 и BRCA2 имеют нормальную структуру, мутации, способствующие развитию рака, могут быть в других генах. Многие из них также можно обнаружить с помощью метода NGS.Иногда результат бывает неопределенным. Это означает, что обнаружена некая мутация, но нет доказательств, что она повышает риск рака.
Если результат анализа на мутации BRCA отрицательный, но есть факторы, явно указывающие на то, что рак может быть наследственным, нужно снова проконсультироваться с клиническим генетиком. Врач решит, что делать дальше.
Что делать, если обнаружен генетический дефект? Можно ли снизить риск рака?
Женщины, у которых обнаружены мутации в генах BRCA1 и BRCA2, нуждаются в более тщательном наблюдении. Девушка должна уметь проводить самообследование молочной железы и с 18 лет делать это раз в месяц. С 25 лет рекомендуется ежегодно являться на осмотры к маммологу.
Кроме того, эксперты рекомендуют с 25 до 30 лет ежегодно проходить МРТ молочных желез, если ее невозможно выполнять — маммографию. С 30 лет показаны ежегодные маммографии и МРТ с контрастом.
Чтобы снизить риски, врач может предложить одну из двух мер:
- Профилактическое лечение тамоксифеном — гормональным препаратом, который блокирует эффекты эстрогенов.
- Профилактическое удаление молочных желез и/или яичников. После двусторонней мастэктомии риск рака молочной железы снижается на 90–95%.
Как лечат рак молочной железы с мутациями BRCA?
Наличие этих мутаций влияет на прогноз и выбор тактики лечения. У таких женщин повышен риск возникновения второй злокачественной опухоли в той же или другой молочной железе, поэтому зачастую хирурги рекомендуют двустороннюю мастэктомию, в то время как у пациентки без мутаций можно было бы обойтись органосохраняющей операцией.
Опухоли молочной железы с дефектами в генах BRCA1 и BRCA2 часто являются тройными негативными, то есть у них отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2. Такой рак сложнее лечить, против него неэффективны гормональные и некоторые таргетные препараты. Прогноз менее благоприятный.
Так как гены BRCA участвуют в репарации ДНК, то раковые клетки, в которых их функция нарушена, более чувствительны к химиопрепаратам, повреждающим ДНК, таким как цисплатин. Если опухолевые клетки имеют рецепторы к половым гормонам, они чувствительны к химиопрепаратам из группы таксанов.
Рост опухоли могут остановить ингибиторы PARP — препараты, которые нарушают восстановление поврежденной ДНК. В результате в раковых клетках накапливается еще больше мутаций, что и приводит к их гибели. К этой группе относятся препараты олапариб (Линпарза), рукапариб (Рубрака).
В Европейской клинике применяются наиболее современные анализы для выявления мутаций в генах BRCA1 и BRCA2, проводится лечение злокачественных опухолей в соответствии с современными международными протоколами. Мы знаем, как бороться с раком в сложных случаях. У нашего онколога вы можете получить консультацию, узнать о ваших рисках и о том, какие виды скрининга рекомендуется регулярно проходить в вашем случае.
Записьна консультациюкруглосуточно+7 (495) 151-14-538 800 100 14 98
Список литературы:
Источник: https://www.euroonco.ru/terms-from-a-z/mutatsii-v-genah-brca
Мутация генов BRCA1 и BRCA2: анализ на предрасположенность к раку молочной железы

Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ).
Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome).
Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2.
Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству.
Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем.
Но вероятность выхода ее из строя также очень высока.
При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
- сначала исследуется присутствие самых частых мутаций (4 мутации)
- при отсутствии таковых и клинической необходимости возможно проведение расширенного анализа (8 мутаций) и/или анализа полной последовательности генов BRCA1 и BRCA2.
С марта 2020 г. лаборатория молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова, возглавляемая членом-корреспондентом РАН, профессором Евгением Наумовичем Имянитовым, включена в систему ОМС (обязательного медицинского страхования).
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»).
Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG.
Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации brca1 и brca2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
- Пациенты до 45 лет с диагнозом рак молочной железы
- Пациенты в возрасте до 50 лет с РМЖ, если в семье есть хотя бы один близкий кровный родственник с таким диагнозом
- Также в том случае, если у пациента до 50 лет с РМЖ семейная онкологическая история неизвестна
- Если в возрасте до 50 лет диагностировано множественное поражение молочных желез
- Пациенты с РМЖ в возрасте до 60 лет — если по результатам гистологического исследования опухоль является трижды-негативной (отсутствует экспрессия маркеров ER, PR, HER2).
- При наличии диагноза рак молочной железы в любом возрасте — если присутствует хотя бы один из следующих признаков:
- не менее 1 близкой родственницы с РМЖ в возрасте менее 50 лет;
- не менее 2 близких родственниц с РМЖ в любом возрасте;
- не менее 1 близкой родственницы с РЯ;
- наличие не менее 2 близких родственников с раком поджелудочной железы и/или раком предстательной железы;
- наличие родственника-мужчины с раком грудной железы;
- принадлежность к популяции с высокой частотой наследственных мутаций (например, евреи Ашкенази);
- Все пациенты с диагностированным раком яичников.
- Если диагностирован рак молочной железы у мужчины.
- Если диагностирован рак простаты (с индексом по шкале Глисона >7) при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если диагностирован рак поджелудочной железы при наличии не менее одного родственника с РЯ или РМЖ в возрасте менее 50 лет или при наличии не менее двух родственников с РМЖ, раком поджелудочной железы или раком простаты.
- Если рак поджелудочной железы диагностирован у уиндивидуума, принадлежащего к этносу евреев Ашкенази.
- Если у родственника обнаружена мутация BRCA1 или BRCA2
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
- Ежемесячное самообследование с 18 лет
- Клиническое обследование молочных желез (маммография или магнитно-резонансная томография) с 25 лет.
- Мужчинам-носителям мутации в генах BRCA1/2 рекомендовано проведение ежегодного клинического обследования грудных желез начиная с 35-летнего возраста. С 40 лет целесообразно выполнение скринингового обследования предстательной железы.
- Проведение дерматологического и офтальмологического осмотров c целью ранней диагностики меланомы.
Как предрасположенность к РМЖ и РЯ передается по наследству
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»).
Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG.
Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Источник: https://nii-onco.ru/diagnostika/analiz-genov-brca1-i-brca2/
