ПЦР Полиморфизмы генов системы свертывания. Планирование беременности
Содержание
Мутация генов гемостаза: проявления и последствия — Диагно
Гемостаз является сложным многокомпонентным процессом, который призван обеспечивать остановку кровотечения при повреждении сосудов кровеносной системы. Этот процесс обеспечивает появление свертка белка — фибрина, требующегося при восстановлении плотности тканей, а также его ликвидацию, в случае если этот белок не требуется.
Система гемостаза осуществляет выполнение двух основных своих функций.
- Поддержание крови при ее движении по сосудам кровеносной системы в состоянии жидкости.
- Активное реагирование на повреждение сосудов системы или реагирование на нарушения связанные с их работой.
Система гемостаза является многокомпонентной. В ее состав входят тромбоциты, элементы стенки сосудов, некоторые факторы ткани и плазмы которые влияют на сворачиваемость крови, противосвертывающие факторы и некоторые другие.
При нарушении равновесия в одном из компонентов происходит разбалансировка связанных с этим компонентом других факторов, что приводит к возникновению патологий гемостаза и к появлению нарушений системы гемостаза.
Последняя патология включает в себя появление плохой свертываемости крови, повышение вероятности появления тромбов внутри кровеносных сосудов или же появление плохой свертываемости крови.
Нарушения системы гемостаза, мутации генов
Мутации гемостаза обычно протекают без проявления каких-то симптомов. Обнаружение этого вида патологии в организме, как правило, происходит при осуществлении хирургического вмешательства, при возникновении переохлаждения организме или в процессе беременности.
Опасными становятся мутации гемостаза для людей в возрасте от пятидесяти лет, так как этот возраст начинает характеризоваться ухудшением работы всех систем организма. Органы и системы органов в пятидесятилетнем возрасте начинают работать значительно хуже, нежели в молодом возрасте и не способны своей работой компенсировать возникающие нарушения.
Игнорировать такого типа диагноз не следует ни в коем случае, так как развитие недуга способно быстро привести организм пациента к возникновению инсультов и инфарктов.
Этот анализ желательно также проводить даже при предполагаемой небольшой потери крови.
В случае наличия у пациента варикозного расширения вен или нарушений связанных с работой такого органа как печень, коагулограмма проводится в обязательном порядке, чтобы избежать возможных неприятностей в будущем.
Выявление нарушений работы гемостаза на ранних этапах способствует тому, что при правильной постановке диагноза и использовании соответствующих препаратов осуществляется купирование негативных последствий недуга, а это в свою очередь помогает избавиться от неприятностей и нарушений в организме вызванных нарушениями работы системы гемостаза.
В последнее время благодаря наличию в лабораториях современного оборудования, а также благодаря наличию современных медицинских методик анализа медработники способны обнаруживать мутации генов гемостаза на самых ранних стадиях развития недугов.
В лаборатории можно определить мутации генов, к примеру, сразу после приема медпрепаратов имеющих гормональную основу.
После проведения анализов и получения их результатов следует для назначения лечения проконсультироваться с медицинским специалистом в этой области.
Научно доказано, что патологии смещения гемостаза развиваются в организме при нехватке витаминов или белков, а также вследствие передачи патологически измененной генной информации от родителей к детям. Патологическое смещение гемостаза происходит также под действием компонентов присутствующих в табачном дыме.
Источник:
Расшифровка «мутаций гемостаза» или генетических полиморфизмов системы гемостаза
Что такое наследственные тромбофилии Наследственные (генетические) тромбофилии – это обусловленные генетическими дефектами нарушения свойств крови («мутации системы гемостаза») и строения сосудов. Генетическая тромбофилия наследуется от родителей – от одного или обеих. Ген может быть один или несколько.
Носительство может проявиться в детском возрасте, в период беременности, при приёме оральных контрацептивов, на протяжении жизни или никогда.
- Как действуют мутации?
- Когда гинеколог назначает анализ на мутации системы гемостаза
- Какие полиморфизмы сдаются?
Выявлено много генов, так или иначе ассоциированных со свертываемостью крови.
При мутациях в одних генах может повышаться риск тромбозов, сердечно-сосудистых нарушений, невынашивания беременности, осложнений на поздних сроках беременности. А мутации в других генах действуют наоборот, снижая свертываемость крови, уменьшая вероятность тромбоза. Третья группа генов влияет не на само свертывание крови, а на то, как организм будет воспринимать лекарства.
Мутации генов системы гемостаза проявляются с неодинаковой силой. Есть наиболее значимые и «опасные», например, мутация протромбина или лейденская мутация. А если такие, которые сами по себе не дают выраженного действия, но усиливают действие друг друга или основных мутаций.
Полиморфизм генов гемостаза назначается гинекологом в четырех основных случаях — невынашивание беременности, подготовка к ЭКО, осложнения беременности, планирование контрацепции. Так как разные мутации могут действовать совместно, усиливая действие друг друга, для понимания картины и выявления причины лучше сдавать полный блок анализов.
Комплексное обследование: Полиморфизм генов системы гемостаза и метаболизма фолатов, полное обследование, 12 показателей. Генетические полиморфизмы, ассоциированные с риском развития тромбофилии и нарушениями фолатного обмена.
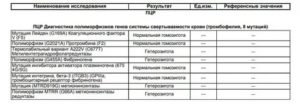
Ген F2 – протромбин (фактор II свертывания крови), кодирует предшественник тромбина. Ген F5 – проакцелерин (фактор V свертывания крови), кодирует белковый кофактор при образовании тромбина и з протромбина. Ген MTHFR (метилентетрагидрофолатредуктаза).Ген PAI1 – серпин (антагонист тканевого активатора плазминогена) Ген FGB – фибриноген (фактор I свертывания крови). Ген F7 – проконвертин, или конвертин (коагуляционный фактор VII свертывания крови). Ген F13A1 – фибриназа (фактор XIII свертывания крови). Ген ITGA2 – α–интегрин (тромбоцитарный рецептор к коллагену).
Ген ITGB3 – интегрин (GpIIIa) (тромбоцитарный рецептор фибриногена, или тромбоцитарный гликопротеин IIIa).
Ген MTR (В12-зависимая http://www.cirlab.ru/price/143621/
Как расшифровать анализы на мутации
Немного о генетике. В организме человека 46 хромосом, 22 пары так называемых аутосом и 1 пара половых: у женщины это две Х хромосомы (ХХ), у мужчины — Х и Y.
Из пары одна хромосома достаётся от мамы, а вторая — от папы.
В хромосоме выделяют гены — участки хромосомы, которые несут целостную информацию. В каждой хромосоме свой набор генов, расположенных в одинаковых местах. В парных хромосомах в одном месте находятся одинаковые гены, например, ген того же протромбина.
Но так как хромосомы достаются от разных родителей, варианты гена могут быть разными. Например, от мамы обычный ген протромбина, а от папы — с мутацией, повышающей риск тромбоза. Это называют вариантами или полиморфизмом генов.
Если у человека одинаковые варианты в обеих хромосомах, это называется гомозиготностью, если разные — гетерозиготностью.
Кстати, я специально указала, что у мужчины разные половые хромосомы. Это означает, что информация из Х и Y хромосомы у мужчины представлена в одном экземпляре!
Пример расшифровки анализа Мутацией Лейдена называют состояние, когда в гене фактора V свертывания крови один крохотный « кусочек» гена — гуанин — заменяется на другой — аденин, в месте под номером 1691.
Эта замена приводит к тому, что в белке, который кодируется этим геном, одна аминокислота (структурная единица белка) заменяется на другую (аргинин на глутамин).
Правильная запись этого варианта гена может быть такой: G1691A (замена гуанин на аденин); Arg506Gln (замена аргинина на глютамин) или R506Q (R — однобуквенное обозначение аргинина, Q — однобуквенное обозначение глютамина). При проведении анализа на полиморфизмы генов исследуется оба гена для поиска искомого полиморфизма (мутации).Варианты заключений по этому гену:
G/G – то есть в обоих вариантах генов гуанин, замены нет, то есть вариант гена без лейденской мутации G/A – в одном варианте есть полиморфизм, называемый лейденской мутацией, а в другом нет (генерозигота) A/A – в обоих вариантах генов обнаружен полиморфизм G1691A Это одна из «опасных» мутаций, которая встречается примерно у 2 человек из 100.
Например, вариант гена V фактора свертывания крови, называемый лейденской мутацией, связан с тромбофилиями (склонность к развитию тромбозов). Тромбозы развиваются при наличии дополнительных факторов риска: приема гормональных контрацептивов (риск тромбозов повышается в 6 — 9 раз), наличия других мутаций, присутствия некоторых аутоантител, повышения концентрации гомоцистеина, курении.
При наличии мутации даже в одной копии гена, повышается риск тромбоза вен нижних конечностей, тромбоэмболии лёгочной артерии, тромбозы сосудов головного мозга, тромбозов артерий в молодом возрасте.
У пациенток с лейденской мутацией возможны привычное невынашивание беременности, поздние осложнения беременности, отставание развития плода, фетоплацентарная недостаточность.
Сдать анализ http://www.cirlab.ru/price/143621
Спросить гемостазиолога http://www.cironline.ru/blogs/index.php?page=post&blog=cironline-blog&post_id=189
Источник:
Мутации генов гемостаза: причины возникновения и коррекция | Блог Medical Note о здоровье и цифровой медицине
Гемостаз — одна из важнейших систем организма, которая отвечает за нормальную свертываемость крови и остановку кровотечений. Правильное функционирование этой системы определяет здоровое состояние кровеносных сосудов, сохранение жидкого состояния крови.
В то же время мутации гемостаза могут привести к различным серьезным патологиям, например, развитию тромбозов, сердечно-сосудистых заболеваний, невынашиванию беременности.
О причинах возникновения мутаций и способах их коррекции рассказывает гемостазиолог Седа Майрабековна Баймурадова — научный руководитель Научного центра гемостаза, тромбоза и фетальной медицины, врач акушер-гинеколог, доктор медицинских наук.
Седа Майрабековна, какие мутации генов гемостаза выделяют в медицине и каковы причины их возникновения?
— В настоящее время к мутациям генов гемостаза относятся мутация FVLeiden, FIIG20210A, дефицит протеина С, дефицит протеина S.
Что же касается причин их возникновения, то отмечу, что мутации генов гемостаза связаны главным образом с наследственным фактором, то есть мы рождаемся с этими генами или полиморфизмами, это то, что мы получили по наследству от своих родителей, они с нами с рождения.
Возможно, природа появления этих мутаций компенсаторная — возмещающая. Кровотечение сопровождает рождение человека, и должен быть механизм внутри человека, который остановит это кровотечение.
Но в ряде случаев тромбофилия (состояние организма, характеризующееся повышенным тромбообразованием) работает как причина серьезных осложнений со здоровьем.
Какие гены гемостаза наиболее часто подвержены мутациям?
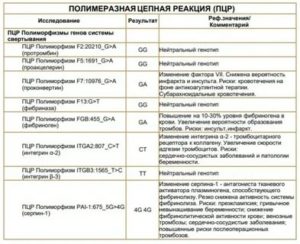
— У каждого четвертого человека в популяции может быть та или иная мутация генов тромбофилии, например, «675 4G/5G» в гене ингибитора активатора плазминогена 1-типа PAI-1, полиморфизм «163G/Т» в гене A-субъединицы фактора XIII, «I/D» в гене тканевого активатора плазминогена, «-455G/A» в гене фибриногена β-субъединицы, «1565 Т/С» в гене гликопротеина Gp-IIIa тромбоцитов, MTHFRC677T.
В чем опасность мутаций гемостаза?
- — Наличие мутаций гемостаза является фактором риска внезапных осложнений — тромбозов, инфарктов, инсультов.
- У женщин в период беременности мутации гемостаза также могут привести к невынашиванию и угрозе невынашивания, гестозам, способствовать бесплодию.
- Кроме того, генетическая предрасположенность к тромбофилии может приводить к возникновению сердечно-сосудистых заболеваний (АГ, атеросклероз, мерцательная аритмия).
В каких случаях необходимо обследование на мутации генов гемостаза?
- — Обследование на мутации генов гемостаза показано в следующих случаях:
- — при наличии тромбоза, инфаркта или инсульта в анамнезе, если в роду у пациента есть родственники с такими заболеваниями;
- — при невынашивании, отягощенном течении беременности (угроза прерывания, гестоз, ПОНРП — преждевременная отслойка нормально расположенной плаценты);
- — при бесплодии и неудачах ЭКО.
Возможна ли коррекция мутаций гемостаза во время беременности?
— Да, при условии, что мы знаем, какие мутации и в каких сочетаниях выявлены у пациенток.
Коррекция влияния тромбофилии на организм пациентки возможна двумя способами. Первый — это традиционное лечение при наличии проблем со здоровьем. Здесь мы назначаем лечение, ориентируясь на результаты анализов и имеющиеся жалобы.
Второй способ профилактический: на основании только результатов анализов.
Расскажите, пожалуйста, о диагностике и способах коррекции мутаций гемостаза
— Анализ на мутации тромбофилии сдается один раз в жизни, и его результаты не меняются. Соблюдения специальных условий перед сдачей анализа нет, то есть можно сдать кровь на наследственную тромбофилию в течение дня независимо от того, поел пациент или нет.
Обследование помимо стандартной диспансеризации (общий анализ крови и мочи, ЭКГ) должно включать скрининг анализ крови на определение состояния кровотоков-гемостазиограмма +ДДимер, АТ 3, Парус-тест. Этот анализ поможет своевременно выявить скрытую угрозу здоровью пациента и предупредить вышеописанные осложнения.
Источник: https://mrt86.ru/prochee/mutatsiya-genov-gemostaza-proyavleniya-i-posledstviya.html
Свертываемость крови как признак наследственной патологии

Нарушения гемостаза имеют врожденный и приобретенный характер. Те, которые передались по наследству, являются генетическими. Такая патология приводит к усилению или уменьшению свертываемости крови, которая обычно наследуется как признак полиморфизма генов.
Первыми эту проблему чаще всего замечают акушеры-гинекологи, когда во время родов возникают коагулопатии. Также проблемы с системой гемостаза провоцируют внутриутробную гибель плода, привычное невынашивание беременности, ее осложнения или бесплодие, которая может быть обусловлена аутоиммунными заболеваниями родителей.
Поэтому на этапе планирования беременности необходимо пройти полное обследование, чтобы максимально устранить эти риски.
Полиморфизмы генов системы свертываемости крови
Врачи утверждают, что полиморфизмы генов системы свертываемости крови не всегда обуславливают патологию, но они отыгрывают значительную роль в ее развитии.
Поэтому при их обнаружении во время обследования будущих родителей информируют о том, что существует риск, который измеряется отношением возможности.
В западных странах обязательно во время беременности изучают мутации генов FV, F2, PAI-1, MTHFR.
Необходимо отметить, что свертывающая система крови – огромная совокупность всевозможных биохимических процессов, призванных поддерживать кровь в жидком состоянии, что обеспечивает нормальную ее вязкость и своевременную остановку кровотечений. Она содержит факторы, которые отвечают за свертываемость, кровоточивость и растворение тромбов. Нарушение такого гомеостаза за счет воздействия различных триггеров ведет за собой тяжелые осложнения, которые иногда очень тяжело остановить.Например, больной гемофилией может погибнуть от незначительного пореза, если ему не оказать медицинскую помощь, при этом гемофилией страдает достаточно большое количество людей. Инфаркты, ишемические инсульты или другие сосудистые катастрофы также имеет огромную долю летальных исходов, при этом они могут наследоваться либо формироваться по причине генетических мутаций и полиморфизмов.
Полиморфизм гена АСЕ
Этот ген оказывает влияние, по своей сути кодирует работу системы АПФ, занимающейся регуляцией артериального давления и нормального водно-солевого метаболизма. При проведении обследования у генетика, расшифровка укажет на два варианта – наличие и отсутствие интрона гена. Если его нет, то на треть повышается риск развития следующих заболеваний:
- гипертоническая болезнь;
- сосудистые катастрофы – инфаркты, инсульты, тромбозы;
- ТЭЛА;
- нефропатия.
Высокая свертываемость обусловлена снижением количества воды в циркуляторном русле. Для исследования берут цельную кровь, анализ проводится методом ПЦР или рестрикционно. Лечение полиморфизма зависит от развившейся патологии.
Полиморфизм коагуляционного фактора F5 V
Это заболевание также называют мутацией Лейден или симптомом наследственных нарушений свертывания крови. Оно связано с образованием тромбина, отображает риск венозных тромбозов.
Ее распространенность достигает 5%. 7-кратное увеличение риска наблюдается тогда, когда мутация определяется рецессивным геном, то есть речь идет о том, что возникла рецессивная мутация у гетерозигот.
При гомозиготности он увеличивается в 100 раз.
Существуют триггерные факторы по риску полиморфизма:
- прием таблетированных контрацептивов;
- беременность;
- заместительная терапия гормонами;
- оперативные вмешательства;
- наличие центрального венозного доступа (подключичная вена) анамнезе;
- гиподинамия;
- путешествия на самолетах;
- инфекции или онкологические процессы.
Наличие такой мутации провоцирует нарушение свретываемости крови, а также приводит к таким осложнениям беременности, как ранний выкидыш, задержка внутриутробного развития, гестоз и другие. Повышение свертываемости провоцирует артериальные эмболии и сосудистые катастрофы.
Читать также Почему не останавливается кровь после удаления зуба
Полиморфизм коагуляционного фактора F2 20210 G
Среди всего исследования, генетический анализ на второй фактор свертываемости или протромбин, является одним из самых важных. Он является предвестником тромбина.
При его недостатке состояние системы свертываемости ухудшается, что проявляется появлением кровотечений. Если же экспрессия гена повышена, то вместо плохой свертываемости крови развивается гиперкоагуляция.
Мутация наследуется аутосомно-доминантно. Носителями считается около 3% людей.
Клиническая картина включает бесплодие, гестозы, преэклампсия, привычное невышашивание беременности, а также задержка и нарушение внутриутробного развития со стороны репродуктивной системы. Со стороны коагулопатий чаще отмечается повышение риска тромбообразования и тромбозом, эмболий, что проявляется сосудистыми катастрофами. Лечение зависит от симптоматики.
Полиморфизм гена MTHFR C677T
Этот ген программирует последовательность фермента, участвующего в метаболических процессах фолиевой кислоты, которая играет большую роль в синтезе метионина и S-аденозилметионина.
При дефиците фермента активируются онкогены и клеточные гены, накапливается гомоцистеин. При беременности повышается воздействие тератогенных факторов, а вероятность рождения здорового ребенка снижается.
Если генотип материнского организма содержит такой полиморфизм, необходимо обязательно следовать всем рекомендациям генетика.
Полиморфизм имеет связь с заменой цитозина на тимин в 677 позиции, что влечет за собой замену остатка аланина на валин в позиции 223, которая отвечает за связывание фолиевой кислоты. У гомозигот теряется термолабильность, из-за чего происходит потеря активность в двух случаях из трех.
У гетерозигот отмечаются сердечно-сосудистые патологии, нарушения внутриутробного развития, рак половых органов. У гомозиготных женщин в период беременности отмечается нарушения внутриутробного развития плода, проявляющиеся патологией нервной трубки.
Усугубляется патология факторами внешней среды и вредными привычками.
Лечение патологических процессов симптоматическое.
Показания к проведению теста:
- гипергомоцистинемия;
- врожденные пороки нервной, сердечно-сосудистой и мочеполовой систем;
- хромосомный синдром при здоровых отце и матери;
- ишемическая болезнь сердца, гипертензия, в том числе наличие этих патологий у ближайших родственников;
- бесплодие, невынашивание беременности.
Исследуется цельная кровь, метод проведения анализа – ПЦР.
Полиморфизм коагуляционного фактора F7 ARG353GLN
Нормальные условия подразумевают то, что 7 и 3 факторы взаимодействуют, тем самым активируют работу фактора IX и X. То есть они все участвуют в формировании сгустка крови. Если развился полиморфизм F7 ARG353GLN, то снижается экспрессия гена, что снижает свертываемость.
Показанием к проведению данного анализа является изучение рисков сосудистых катастроф, а также тромбоэмболические процессы.
Симптоматика обуславливает гиперкоагуляцию, повышенный риск смерти по ее причине. Лечение такой мутации симптоматическое.
Полиморфизм тромбоцитарного рецептора фибриногена
Этот рецептор играет роль во взаимодействии тромбоцитов с фибриногеном, что обуславливает их повышенную агрегацию. Патология генетического кода подразумевает замену цитозана на тимин, из-за чего меняется аминокислота рецептора. Это приводит к изменению его свойств. Отмечается повышенная агрегация форменных элементов. Симптоматически встречаются:
- сосудистые катастрофы – инфаркты, инсульты;
- коронарный синдром;
- тромбозы.
Важно отметить, что люди, у которых была определена такая мутация, намного лучше реагируют на назначение антиагрегантной терапии аспирином или клопедогрелем.
Показания к проведению теста:
- тромбозы, тромбоэмболии у обследуемого или его ближайших родственников;
- сосудистые катастрофы;
- определение успешности атиагрегантной терапии.
Исследуется венозная кровь, определение происходит методом ПЦР.
Полиморфизм фибриногена 455G
Эта мутация приводит к повышению экспрессии гена, который отвечает за продукцию фибриногена. Показанием к анализу служат повышенные цифры фибриногена при изучении коагулограммы, сосудистые катастрофы анамнестически, артериальная гипертензия.
Клинически мутация проявляется тромбозами, кардиоваскулярными патологиями. Изменение уровня фибриногена развивается еще и на фоне приема лекарственных средств, алкоголизма, избыточной массы тела. Лечение симптоматическое, зависит от развившейся патологии.
Читать также Гепарин-индуцированная тромбоцитопения
Полиморфизм ARG353GNL 10976 GA коагуляционного фактора VII F7
Этот ген кодирует прокорвентин, являющийся синтезируюемым в печени белком, который активирует факторы 9, 10 и витамин К. При его недостатке может возникать заболевание гемофилия за счет воздействия фактора 7 на другие.
Хромосома аллельных генов не содержит аденина, что провоцирует изменение всех свойств фермента за счет замены аргинина глутамином. Аллель А встречается у каждого десятого европейца. При полиморфизме развиваются тромбоэмболические процессы, а также тромбозы – инфаркты, инсульты и другие сосудистые катастрофы.
Больные гемофилией, помимо дефицита факторов 8 и 9, могут содержать недостаточное количество фактора 7.
Проконвертин является 7м фактором свертывания крови. По своей сути это профермент, который зависит от витамина К. Его синтез происходит в печени, а главной функцией является активация десятого фактора.Большинство случаев мутации отыгрывают фунцкию защиты от тромбоэмболии. Замена аргинина глутамином приводит к пониженной свертываемости, что также положительно влияет на развитие инфаркта миокарда даже при выраженном атеросклерозе коронарных сосудов.
Полиморфизм IIEMET66 AG мутация редуктазы метионинсинтетазы
Фермент, кодируемый этим геном, воздействует на большинство процессов, которые связаны с перемещением метильной группы. Другой функцией ученые называют обратную трансформацию гомоцистеина в метонин, кофактором здесь выступает коболамин – витамин В12.
Полиморфизм обуславливается заменой аминокислот, за счет чего снижается нормальная активность фермента. Это ведет к повышению риска развития патологий внутриутробного формирования, в том числе нервной системы за счет незарощения нервной трубки.
Дефицит кобаламина значительно утяжеляет явления полиморфизма. Также усиливается гипергомоцистеинемия, если таковая была обусловлена дефектом 677СТ. Количество гомоцистеина увеличивается только при двойной мутации.
Риск появления на свет ребенка с трисомией по 21й хромосоме (болезнь Дауна) повышается до 4% при данной мутации.
Полиморфизм 675 5G4G мутация ингибитора активатора плазминогена PAI1
Белок считается одной из основных составляющей комплекса плазминоген-плазмин. PAI1 блокирует активаторы плазминогена, что определяет подверженность сосудистым катастрофам. Гомозиготный вариант считается одним из их факторов риска. Также стоит подчеркнуть то, что этот ген подвержен стрессу больше, чем все другие известные гены человека.
Клинически при варианте 4G повышается экспрессия гена и уровень PAI1. Это ведет к снижению активности тромболитической системы, что отображается повышенной вязкостью крови, тромбозами.
Риск их возникновения увеличивается почти вдвое.
При этом, согласно многочисленным исследованиям, он растет у тех пациентов, у которых встречался тромбоз внутренних органов и воротной вены, однако корреляция не была установлена.
Такой ген также встречался у лиц, страдающих ожирением. При этом речь идет о центральном, а не периферическом отложении жира.В некоторой мере это обусловлено тем, что такая патология является коморбидной для кардиоваскулярных заболеваний, считается одним из триггерных факторов атеросклероза, инфарктов или инсультов.
Поэтому полиморфизм, влияющий на уровень PAI1 дополнительно повышает риск относительно сердечно-сосудистых проблем.
Показания для проведения такого теста:
- тромбоз воротной вены, а также паренхиматозных или полых внутренних органов;
- наличие инфаркта миокарда в анамнезе или у ближайших родственников;
- острый коронарный синдром;
- ожирение;
- сахарный диабет типа 2.
Следует отметить, что лечение всех клинических проявлений генетических мутаций генов, кодирующих свертываемость крови, зависит от заболевания, которое развилось. Обычно назначается симптоматическая терапия, поскольку на мутацию повлиять никоим образом нельзя, лишь иногда ее можно предупредить, снизив влияние факторов окружающей среды, которые могут ее спровоцировать.
Источник: https://gemato.ru/koagulopatiya/polimorfizm-genov.html
Полиморфизмы генов фолатного цикла и беременность

Как только у женщины появляются мысли стать мамой, то она обращается в женскую консультацию для полного обследования. И в первую очередь врач назначает фолиевую кислоту. Насколько важна роль этого витамина для организма, что такое фолатный цикл и в чем заключается опасность при полиморфизме генов?
Для начала разберемся, что такое полиморфизм генов. Гены у разных людей похожи, но имеют небольшие нюансы, которые и отличают нас друг от друга. Эти нюансы, различия и называются полиморфизмами.
Причиной полиморфизма генов являются изменения отдельных участков в молекуле ДНК, что приводит к изменению свойств гена (иногда в лучшую, а иногда — в худшую сторону). Некоторые изменения ведут к генетическим заболеваниям, другие не влекут за собой болезни, но являются фактором предрасположенности к ряду патологий.
А что же такое фолатный цикл? Фолатный цикл – это совокупность процессов, в результате которых при помощи ферментов и коферментов из гомоцистеина появляется незаменимая аминокислота метионин.
Ферменты — это вещества, ускоряющие биохимические процессы в организме. В фолатном цикле принимают участие 3 фермента:
- метилентетрагидрофолатредуктаза MTHFR (для перевода фолиевой кислоты в активную форму);
- метионин-синтаза-редуктаза MTRR (влияет на активность метионин-синтазы);
- метионин-синтаза MTR (осуществляет превращение гомоцистеина);
Коферменты — это производные витаминов, необходимые для функционирования ферментов.
Коферментами являются фолаты, а для обмена фолатов необходимы витамины:
- В9 (фолиевая кислота);
- В6 (пиридоксин);
- В12 (цианокобаламин).
Фолатный цикл обеспечивает нормальное функционирование органов и систем. При мутации в генах происходит замена одного нуклеотида на другой, изменения числа повторяющихся фрагментов ДНК. Это все ведет к изменению биохимических свойств фермента и его функции, в результате чего нарушается превращение гомоцистеина в метионин.
Сбой в фолатном цикле влечет за собой увеличение концентрации в крови гомоцистеина, оказывающего на организм токсическое, атерогенное и тромбофиличское действие. Иными словами, возрастает риск некоторых осложнений беременности (например, гестоза или отслоения плаценты) и возникновения дефектов у плода.
Из-за чего может нарушиться метаболизм гомоцистеина и произойти сбой в фолатном цикле?
- генетические дефекты ферментов;
- дефицит витаминов вследствие недостаточного поступления с пищей или на фоне приема лекарственных средств (эстрогенсодержащих оральных контрацептивов, цитостатиков, противоэпилептических средств).
Кроме того, повышенный уровень гомоцистеина может быть при хронических заболеваниях: почечной недостаточности, анемии, псориазе, гипотиреозе; злокачественных опухолях яичников, молочной и поджелудочной желез.
Информация о ферментах фолатного цикла (MTHFR, MTRR, MTR) содержится в генах, которые именуются генами фолатного цикла. Эти гены могут иметь свои особенности у каждого человека — полиморфизмы. Исследование полиморфизмов в таких генах способно выявить, есть ли в конкретном случае риск нарушения фолатного цикла.
Важно! Не все полиморфизмы в генах фолатного цикла могут приводить к повышению гомоцистеина.
Диагностика полиморфизмов генов фолатного цикла
Исследование на полиморфизм генов фолатного цикла проводят методом полимеразной цепной реакции. Кровь для анализа лучше сдавать утром натощак, последний прием пищи должен быть накануне вечером.
Расшифровку данных полиморфизма генов фолатного цикла (MTR, MTRR, MTHFR) проводит только врач. Даже при выявленном полиморфизме не надо отчаиваться — это говорит только о предрасположенности к заболеванию и не означает, что в течение беременности обязательно будут осложнения.
Полиморфизмы генов фолатного цикла: в чем риск для матери и плода?
Уровень гомоцистеина при нормально протекающей беременности чуть понижается, составляя 4,6-12,4 мкмоль/л, и восстанавливается только после родов. Но при нарушениях в фолатном цикле он повышается и может оказывать токсическое, тромбофилическое и атерогенное действие.
Все это приводит к развитию различных патологических процессов со стороны матери и плода:
- угроза прерывания беременности;
- неудачное ЭКО;
- неразвивающаяся беременность;
- фетоплацентарная недостаточность;
- хроническая внутриутробная гипоксия плода;
- поздний гестоз;
- внутриутробная задержка роста и развития плода;
- пороки развития плода (дефекты нервной трубки, деформация лицевого скелета с незаращением неба и верхней губы, анэнцефалия);
- повышается риск развития синдрома Дауна.
Планирование беременности при полиморфизмах генов фолатного цикла
При планировании беременности важно выявить возможные хромосомные аномалии, в том числе носительство полиморфизма генов гемостаза и фолатного цикла.
Чтобы исключить наличие какой-либо патологии, обязательно надо посетить акушера-гинеколога. При опросе врач досконально соберет анамнез и при необходимости назначит дополнительное обследование, консультацию генетика.
Уровень гомоцистеина проверяют, если:
- предыдущие беременности завершились неблагоприятным исходом;
- у женщины повышенная свертываемость крови;
- у родственников будущей мамы были тромбозы, инфаркты или инсульты до 50 лет.
Важно! В течение 2-3 месяцев до зачатия всем женщинам совместно с партнером рекомендуют пропить фолиевую кислоту в профилактической дозе 0,4 мг/сутки.
Ведение беременности при полиморфизмах генов фолатного цикла
При наступлении беременности фолиевую кислоту продолжают пить до 12 недель включительно, что обеспечивает снижение риска нарушений со стороны нервной системы плода. Витамин выпускается в таблетках по 1 мг, назначают по 1 таб/сутки.
При полиморфизме дозировка может увеличиваться до 5 мг/сутки, а прием продолжают в течение всей беременности совместно с витаминами группы В. В критические сроки проводят дополнительную терапию.
Врач-генетик может порекомендовать принимать не обычный В9, а фолиевую кислоту в активной форме.
В чем разница? Дело в том, что в чистом виде фолиевая кислота организмом не усваивается — для этого она должна преобразоваться в определенную форму — метилфолат.
При мутации некоторых генов процесс превращения В9 в усвояемую форму нарушен, поэтому обычная фолиевая кислота усваивается плохо. В этом случае препаратом выбора становится ее активная форма — L-метилфолат, который легко всасывается в кровь без каких-либо преобразований.
Рекомендуют употреблять больше пищи с витамином В9 – шпинат, брокколи, горошек, авокадо, банан, арахис, бобовые, белый рис, хлеб из муки грубого помола, печень, мёд, томатный и апельсиновый соки.
В обязательном порядке контролируют уровень гомоцистеина в динамике, коагулограмму.
Врач-гинеколог о гомоцистеине при планировании беременности.
Роды при полиморфизмах генов фолатного цикла
В большинстве случаев на фоне профилактических мероприятий и проводимой терапии роды проходят хорошо.
Но могут быть следующие осложнения:
- преждевременные роды;
- преэклампсия, когда показано оперативное вмешательство в экстренном порядке;
- преждевременная отслойка нормально расположенной плаценты;
- кровотечение.
Главное, не переживайте и соблюдайте все рекомендации.
В послеродовом периоде до окончания кормления грудью продолжайте прием фолиевой кислоты по 0,4-1 мг/сутки.
Владлена Размерица, акушер-гинеколог, специально для Mirmam.pro
Источник: https://mirmam.pro/polimorfizmy-genov-folatnogo-tsikla
Генетические анализы при потерях беременности
Aнализы на генетические полиморфизмы при выкидышах и замерших беременностях в первом триместре
Поскольку 80%[1] потерь приходятся на первые три месяца беременности, только этих ситуаций мы коснемся в статье. Причины потери беременности после 12 недель – предмет отдельного обсуждения.
Непросто поверить, но риск спонтанного прерывания беременности на сроке 6-12 недель у здоровой женщины моложе 35 лет составляет не менее 10%[2], и повлиять на причины этих событий можно в меньшинстве случаев.
Итак, женщина понимает: ребенка не будет. Одно из первых желаний в такие моменты – узнать причину. И находятся желающие эту потребность удовлетворить: ошарашенной женщине назначают многочисленные обследования и анализы, и редко обходится без тестов на:
- «генетические причины потери беременности»
- «полиморфизмы в генах гемостаза и фолатного цикла»
- «мутации предрасположенности к невынашиванию беременности»
- «генетический риск осложнений беременности»
- …
Вариантов названий у этой услуги множество. Суть одна: по материалу матери определяют ее генотип по полиморфизмам нескольких генов.
Когда женщине назначают «генетические анализы» по поводу потери беременности — это в 99% случаев именно анализы на полиморфизмы. Поэтому (с определенным допущением) можно сказать, что анализы на полиморфизмы = генетические анализы, которые назначаются женщинам по поводу потери беременности.
Непросто в двух словах рассказать, что такое полиморфизмы. Полиморфизмы – это незначительные различия в структуре генов, определяющие разнообразие их проявлений. Каждый конкретный полиморфизм «живёт» в определенном гене, немножко изменяя свойства его продукта и, тем самым, проявление какого-то признака. Полиморфизмы – это то, что делает нас разными. Это генетические оттенки, из-за которых один может за милую душу выпить литр молока, а другой после пары глотков будет искать туалет. Благодаря полиморфизмам у нас столько цветов глаз и волос. Из-за них у кого-то кровь сворачивается чуть быстрее среднего, а у кого-то – чуть медленнее. Удивительно, но весь этот спектр форм, цветов и особенностей задается комбинациями четырех букв-нуклеотидов, составляющих наши гены: A, G, T и C. Одну букву мы получаем от мамы, другую – от папы. Так получается наш собственный генотип: например GG, GA или TC. Результатом анализа на полиморфизмы как раз и будут пары букв.Например, в гене фактора свертывания крови V (этот ген называется F5) буквой под номером 1691 может быть G, а может – А. Отсюда три варианта генотипов: GG, GA и AA. Вариант GG — удел большинства людей, ему не свойственны какие-то особенности. Около 2-7% людей имеют генотип GА, то есть несут полиморфизм А (так называемую Лейденскую мутацию), из-за чего склонны к повышенной свертываемости крови. Людей с генотипом АА крайне мало. Грань между понятием «мутация» и «полиморфизм» тонка и неопределенна. Ученые-биологи любое отклонение от «эталона» могут называть мутацией, а врачи-практики обычно считают мутацией только то изменение, которое может приводить к болезни. Поэтому не смущайтесь, что полиморфизм в гене F5 называют Лейденской мутацией. |
Какие полиморфизмы обычно обсуждаются в контексте потери беременности?
Назовём героев этой статьи поимённо!
Не пугайтесь того, что эти названия вам ни о чем не говорят, и пока что поверьте: они и врачу вашему в большинстве случаев ничего не скажут.
- F5: 1691 G>A (Arg506Gln)NB!
- F2: 20210 G>A NB!
- F7: 10976 G>A (Arg353Gln)
- F13: G>T (Val34Leu)
- FGB: -455 G>A
- ITGA2: 807 C>T (Phe224Phe)
- ITGB3: 1565 T>C (Leu33Pro)
- SERPINE1 (PAI-1): -675 5G>4G
- MTHFR: 677 C>T (Ala222Val)
- MTHFR: 1298 A>C (Glu429Ala)
- MTR: 2756 A>G (Asp919Gly)
- MTRR: 66 A>G (lle22Met)
NB! Обратите внимание, что эти два полиморфизма могут играть важную роль в принятии решения о назначении КОК (комбинированных оральных контрацептивов).
Почему врачи назначают анализы на эти полиморфизмы?
Когда ученые узнали о существовании полиморфизмов, они задумались: а нельзя ли использовать это знание для выделения группы людей с предрасположенностью к определенным заболеваниям, и заблаговременно их предупреждать? Известно же: предупредить легче, чем лечить!
Эти времена совпали с подъемом молекулярных технологий, позволивших выполнять тесты на полиморфизмы относительно просто и недорого. Исследователи смекнули, что работы типа «Влияние полиморфизма Х на болезнь Y» генерировать легко и делать это можно практически бесконечно.
Поскольку болезней и полиморфизмов много, всегда была возможность подобрать пару «полиморфизм – болезнь», позволявшую даже из безнадежных данных вытащить мало-мальски значимую связь и опубликоваться, кокетливо умолчав об изъянах дизайна исследования.
Соедините немного логики и статистики – и получите скромное, но научное достижение.
Вот как рассуждали эти исследователи: уже упоминавшаяся Лейденская мутация связана с повышенной свертываемостью крови. Известно, что формирование и функционирование плаценты сильно зависит от агрегатных свойств крови, а при невынашивании беременности в плацентах нередко находят очаги тромбоза.
Логично предположить, что у носительниц Лейденской мутации эти нарушения могут встречаться чаще. Осталось провести исследование и проверить эту гипотезу. Такие исследования были проведены и некоторые показали наличие связи между наличием Лейденской мутации и повышенным риском потери беременности.
Так появилась богатая (на немалую долю отечественная) «литературная база», указывающая на связь между полиморфизмами и предрасположенностью к разным болезням.
Именно на эту «базу» опирались производители реагентов при убеждении врачей в целесообразности назначения тестов на полиморфизмы.Да-да, на определенном этапе потребность в диагностикумах для анализов на полиморфизмы стала так велика, что привлекла производителей реагентов, которые создали коммерческие наборы для выполнения этих тестов. А товар требует продвижения.
Как можно расширить рынок таких наборов? Внедрить тесты на полиморфизмы в клиническую практику! И эти анализы из научных лабораторий стали «заползать» в диагностические.
Когда результаты научных исследований переносятся в клиническую практику без должной оценки последствий, страдают кошельки и нервы пациентов.
Так появились лаборатории, предлагающие тесты на полиморфизмы как медицинские диагностические услуги. Так появились врачи, наученные лабораториями и производителями реагентов, что эти тесты нужно назначать в различных случаях, в том числе при невынашивании беременности. Так сформировалась целая мифология про то, какие полиморфизмы надо выявлять и как их «лечить».
1. Полиморфизмы не являются значимой причиной ранней потери беременности
Около 70% беременностей, прервавшихся в первом триместре, не могли развиваться из-за генетических аномалий ЭМБРИОНА (не матери!!!)[3]. Не путайте с генетическими полиморфизмами!
Полиморфизмы – это генетические особенности мамы, а приводящие к выкидышу нарушения структуры и количества хромосом – это грубые аномалии эмбриона. Возникновение таких эмбрионов – часть жизни, так же, как и их ранняя отбраковка.
Оставшиеся 30% ранних потерь беременности тоже не имеют отношения к полиморфизмам, а обусловлены антифосфолипидным синдромом, неправильным функционированием шейки матки, инфекциями и другими причинами, к которым генетические полиморфизмы матери не относятся.
2. Какие-то полиморфизмы есть у всех людей
В отличие от мутаций, вызывающих редкие генетические болезни, которые встречаются у одного из десятков тысяч людей, какие-то полиморфизмы есть у всех. Каждый день мимо вас проходят люди с такими же GG, GA и TC, как у вас.
Возможно, у них есть дети, но может быть и нет. Есть вероятность, что они сталкивались с потерей беременности, а может быть их это несчастье обошло стороной.
В любом случае: от вас они отличаются тем, что не тратили деньги на анализ полиморфизмов.
3. Полиморфизмы не определяют признак полностью (или на большую часть)
Вернемся к несчастным больным генетическими заболеваниями: их редкий генетический дефект практически на 100% определяет их беду. То, что генетики называют «факторами среды» (поведение, питание, физическая активность) вносит очень маленький вклад в их несчастье. С полиморфизмами наоборот: их вклад очень мал.
Например, вероятность развития венозного тромбоза хоть в некоторой степени и зависит от наличия, например, уже знакомой нам Лейденской мутации, но на львиную долю определяется весом, статусом курения, возрастом, наличием беременности, принимаемыми препаратами и другими факторами.
4. Полиморфизм – не болезнь
Какими бы жуткими словами не сопровождались комбинации из букв A, G, T и C в заключении генетического анализа, они НЕ говорят о том, что у женщины будет, например, «невынашивание беременности».
Пример из жизни:
Когда на бланке результата «Нарушение развития плода – незаращение нервной трубки» написано рядом с «MTRR c.66A>G G/G» любой человек поймёт такую запись как причинно-следственную связь. А это не так.
Наличие полиморфизмов говорит лишь о том, что вы принадлежите к людям, у которых по данным некоторых(!) научных(!!!) исследований эти патологии возникают чаще, чем у людей без ваших полиморфизмов.
И тут мы переходим к следующему факту…
5. Влияние полиморфизмов «видно» только на больших группах людей
Даже будучи специалистом, я не пойму ваш генотип по генам свертывания крови, увидев вашу коагулограмму (анализ на свертываемость крови). А всё потому, что эти различия не «видны» на индивидуальном уровне.
У человека с «плохими» полиморфизмами свертывание может быть «лучше», чем у «генетически идеального».
Лишь среднее значение этого показателя, измеренное в большой группе людей с «плохим» генотипом, будет отличаться от такового у группы с «хорошим».
Немного математики: Иногда в заключении анализа рядом с жуткими «диагнозами» можно увидеть цифры. Например, «Выявленный полиморфизм в 3,5…5,5 раз увеличивает риск венозной тромбоэмболии». Эти цифры – совершенно честные[4] для Лейденской мутации. Этот полиморфизм – один из двух достойных хоть какого-то внимания полиморфизмов системы свертывания крови. Второй – так называемый «полиморфизм протромбина», c. 20210G>A в гене фактора свертывания крови II (F2). Но вернемся к цифрам. Увеличение в 3,5…5,5 раз – это существенно? Конечно существенно! Если мне завтра в три с половиной раза увеличат зарплату, это будет ой как существенно… А если посмотреть не относительный, а абсолютный риск? Когда у вас есть Лейденская мутация, ваш ежегодный риск получить венозную тромбоэмболию равен 0,05…0,2%. Иными словами: Наличие Лейденской мутации означает, что с вероятностью 99,95…99,80% у вас НЕ будет венозной тромбоэмболии (ВТЭ) в течение следующего годаАбсолютный риск ВТЭ настолько мал, что даже увеличение в разы не делает его существенным для жизни отдельного конкретного человека. Беременность в совокупности с Лейденской мутацией повышает риск ВТЭ, но шанс на то, что тромбоза НЕ будет, всё равно не опускается ниже 95%. |
1. «Вылечить» полиморфизмы нельзя
Это часть генотипа, и он останется неизменным до конца жизни. Поэтому тактика «сдать на полиморфизмы – полечить – сдать контрольный анализ» абсурдна по своей сути.
2. Ни один из полиморфизмов не является прямым поводом для назначения лечения
Справедливости ради, стоит отметить, что при невынашивании беременности антикоагулянтная терапия может потребоваться, и она дает неплохие результаты. Но для назначения антикоагулянтов должен быть установлен диагноз «антифосфолипидный синдром» (который может сочетаться или не сочетаться с полиморфизмами в генах системы свертывания).
3. Курантил, актовегин, тромбоасс, пиявки не нужны
Они не имеют доказанной эффективности в улучшении исходов беременности у женщин с полиморфизмами в системе свертывания.
Тестирование женщин даже с неоднократной потерей беременности на наследственные тромбофилии[5] и полиморфизмы фолатного цикла[6] не входит в рекомендации ведущих медицинских организаций, занимающихся этой проблемой. Но в большинстве отечественных «методичек» и рекомендаций по невынашиванию беременности эти исследования входят.
И чтобы не оставлять неопределенности:
Анализы на генетические полиморфизмы женщинам, столкнувшимся с потерей беременности один или несколько раз, делать не нужно
Источники:
[1]https://www.acog.org/Resources-And-Publications/Practice-Bulletins/Committee-on-Practice-Bulletins-Gynecology/Early-Pregnancy-Loss [2] https://www.webmd.com/baby/guide/pregnancy-miscarriage#1 [3] http://emedicine.medscape.com/article/260495-overview#a11 [4] Scott M. Stevens et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis (2016) 41:154–164 [5] Evaluation and treatment of recurrent pregnancy loss: a committee opinion [6] Thrombophilias and recurrent pregnancy loss: a critical appraisal of the literatureКарпачева Клавдия, молекулярный генетик
Источник: http://RumyantsevaMD.ru/polimorphysmy/
