Анализ стекол на генные мутации: корректно ли взятие и хранение
Содержание
Мутации
Автор статьи — Л.В. Окольнова.
Сразу на ум приходят Люди Х… или Человек — Паук …
Но это в кино, в биологии тоже так, но немного более научно, менее фантастично и более обыденно.
Мута́ция (в переводе — изменение) — устойчивое, передающееся по наследству изменение ДНК, происходящее под влиянием внешних или внутренних изменений.
Мутагенез — процесс появления мутаций.
Обыденность в том, что эти изменения (мутации) происходят в природе и у человека постоянно, почти каждодневно.
В первую очередь, мутации подразделяются на соматические — возникают в клетках тела, и генеративные — появляются только в гаметах.
| Соматические мутации | Генеративные мутации |
| Не всегда передаются при половом размножении.Передаются при вегетативном (бесполом размножении). | Передаются по наследству. |
Разберем сначала виды генеративных мутаций.
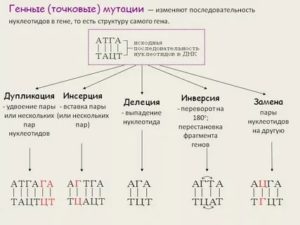
Генные мутации
Что такое ген? Это участок ДНК (т.е. несколько нуклеотидов), соответственно, это и участок РНК, и участок белка, и какой-либо признак организма.
Т.е. генная мутация — это выпадение, замена, вставка, удвоение, изменение последовательности участков ДНК.
Вообще, это не всегда ведет к болезни. Например, при удвоении ДНК случаются такие “ошибки”. Но они возникают редко, это очень малый процент от всего количества, поэтому они незначительны, что практически не влияют на организм.Бывают и серьезные мутагенезы:- серповидно-клеточная анемия у человека;- фенилкетонурия — нарушение обмена веществ, вызывающее довольно серьезные нарушения умственного развития- гемофилия
— гигантизм у растений
Геномные мутации
Вот классическое определение термина “геном”:
Геном—
— совокупность наследственного материала, заключенного в клетке организма;- геном человека и геномы всех остальных клеточных форм жизни, построены из ДНК;
— совокупность генетического материала гаплоидного набора хромосом данного вида в парах нуклеотидов ДНК на гаплоидный геном.
Для понимания сути мы очень сильно упростим, получится такое определение:
Геном — это количество хромосом
Геномные мутации — изменение числа хромосом организма. В основном, их причина — нестандартное расхождение хромосом в процессе деления.
— синдром Дауна — в норме у человека 46 хромосом (23 пары), однако при этой мутации образуются 47 хромосом
рис. синдром Дауна
— полиплойдия у растений (для растений это вообще норма — большинство культурный растений — полиплойдные мутанты)
Хромосомные мутации — деформации самих хромосом.
Примеры (некоторые перестройки такого рода есть у большинства людей и вообще никак не отражаются ни внешне, ни на здоровье, но есть и неприятные мутации):- синдром кошачьего крика у ребенка- задержка в развитии
и т.д.
Цитоплазматические мутации — мутации в ДНК митохондрий и хлоропластов.
Есть 2 органеллы со своими собственными ДНК (кольцевыми, в то время как в ядре — двойная спираль) — митохондрия и растительные пластиды.
Соответственно, есть мутации, вызванные изменениями именно в этих структурах.
Есть интересная особенность — этот вид мутации передается только женским полом, т.к. при образовании зиготы остаются только материнские митохондрии, а “мужские” отваливаются с хвостом при оплодотворении.
Примеры:- у человека — определенная форма сахарного диабета, туннельное зрение;
— у растений — пестролистность.
Соматические мутации
Это все описанные выше виды, но возникают они в клетках тела ( в соматических клетках).
Мутантных клеток обычно намного меньше, чем нормальных, и они подавляются здоровыми клетками. (Если не подавляются, то организм перерождаться или болеть).
Примеры:- у дрозофилы глаз красный, но может иметь белые фасеты
— у растения это может быть целый побег, отличающийся от других (И.В. Мичурин таким образом выводил новые сорта яблок).
— раковые клетки у человека
Примеры вопросов ЕГЭ:
Синдром Дауна является результатом мутации
1))геномной;
2) цитоплазматической;
3)хромосомной;
4) рецессивной.
Ответ: 1.
Генные мутации связаны с изменением
А) числа хромосом в клетках;
Б) структуры хромосом;
B) последовательности генов в аутосоме;
Г) нуклеогидов на участке ДНК.
Ответ: Г.
Мутации, связанные с обменом участками негомологичных хромосом, относят к
А) хромосомным;
Б) геномным;
В) точковым;
Г) генным.
Ответ: А.
Животное, в потомстве которого может появиться признак, обусловленный соматической мутацией
А) гидра
Б) волк
В) еж
Г) выдра
Ответ: А.
Источник: https://ege-study.ru/ru/ege/materialy/biologiya/mutacii/
BRAF мутация при меланоме
Меланома считается коварной болезнью. Часто она быстротечна, склонна к рецидивам, имеет несколько форм и трудно диагностируется на начальных стадиях. Развиваясь, раковые клетки мутируют. Для разработки курса лечения необходимо понимать, какую именно мутацию прошла болезнь в конкретном случае. Если вовремя подобрать препараты, жизнь пациента можно спасти.
BRAF мутация – важный показатель степени опасности болезни меланомы.
Что это такое BRAF?
Чаще всего при развитии меланомы у больных встречаются следующие виды мутации: BRAF, c-Kit, NRAS. Браф мутация встречается в 45―65% случаев. Для проведения корректной таргетированной терапии врачу необходимо понимать, произошла ли мутация клеток и в каком русле. Это исследование проводится на этапе образования метастазов, когда стандартных методов лечения уже недостаточно.
Браф — ген, отвечающий за сигнальный путь в клетке. В здоровом состоянии этот путь неактивен, однако при появлении мутации продуцируется активированный белок, который вызывает избыточный перенос к факторам роста. Как результат — клетки размножаются в ускоренном темпе, что приводит к неконтролируемому росту раковой опухоли.
Причина возникновения браф мутаций при меланоме
Меланома, как и любой другой тип рака вызывается патологией генов, отвечающих за деление злокачественных клеток. Как правило, таких мутаций должно быть около 4―6-ти для запуска болезни.
Однако существует определенный тип генов, которых достаточно для начала неконтролируемого деления клеток опухоли. К ним относится BRAF.
Если у пациента мутирует ген BRAF, его болезнь называют BRAF-положительной меланомой.
Для диагностики BRAF мутации меланомы проводятся сложные лабораторные молекулярные пробы.
Диагностика и анализы
По международным стандартам анализ проводится в обязательном порядке на 3-й и 4-й стадиях рака. Возможна диагностика на 1-й и 2-й стадии, если врач наблюдает быстрое течение болезни. Для выявления гена braf мутации проводятся молекулярные пробы, а именно тест на V600E и полимеразная цепная реакция в режиме реального времени. Алгоритм сдачи биопробы:
- Используется ткань опухоли, которая была взята у больного путем хирургического иссечения для гистологического исследования. При этом могут использоваться первичные ткани с меланомой на коже и метастазные образования.
- Материал для анализа доставляется в лабораторию в формалине или сразу же после операции.
- Лаборант фиксирует на стеклах парафиновые блоки. При этом должна быть четко видна граница между здоровой и больной тканями образца. Если это условие выполнить невозможно, используют парафиновые блоки с генетическим материалом.
Такое исследование особо важно для пациентов, у которых нельзя удалить раковые ткани. Если в городе проживания пациента это исследование не проводится, больной может самостоятельно взять парафиновый блок с образцом клеток и перевезти его в город, где этот анализ возможен. Для обеспечения точности анализа должно быть более 20% злокачественных клеток.
Своевременная диагностики BRAF мутации меланомы стоит пациенту жизни.
Важность ранней диагностики
Меланома развивается быстро. Очагом чаще являются родинки, имеющиеся на теле каждого человека. Развитие заболевания происходит на ДНК уровне, поэтому регулярные осмотры кожных покровов крайне важны.
Если заболевание установлено, положительный результат анализа гена BRAF говорит лечащему врачу о необходимости коррекции курса лечения. При меланоме время — враг пациента. Четких норм количества выявленных мутаций не существует.
Исследование проводят исключительно для определения эффективности выбранного курса препаратов и процедур. Если установить диагноз на ранних стадиях, меланома хорошо реагирует на таргетное лечение.
Отсутствие в образце анализа мутации свидетельствует об эффективности выбранного курса лечения.
Лечение мутации
Получив сведения о braf гене на этапе моделирования курса терапии, врач сможет прописать новейшие лекарственные средства, угнетающие активность мутации и увеличивающие шансы пациента.
Несколько лет назад медиками Израиля успешно внедрены методики, при которых атака на раковые клетки проводится вне зависимости от их локализации. При этом препарат действует локально, не задевая здоровых клеток, как при стандартной химиотерапии.
Уменьшение побочных эффектов по сравнению с традиционными методами лечения — еще одно преимущество локального лечения. Прием этих препаратов значительно продлевает жизнь раковых больных.
Источник: http://StopRodinkam.ru/obrazovaniya/melanomy/braf-mutaciya-pri-melanome.html
Анализ на генетическую предрасположенность к раку, генетический анализ на рак молочной железы

Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям.
Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов.
За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Каждая клетка человеческого организма содержит около 30 тысяч генов. Среди них есть те, которые контролируют рост и размножение клетки, ее продолжительность жизни, отвечают за «починку» поврежденной ДНК.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни.
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Показания:
Генетические исследования в онкологии помогают решать важные задачи:
- Обнаружить наследственные мутации и оценить риск развития рака, своевременно принять профилактические меры.
- Разобраться, есть ли у человека генетические дефекты, связанные с повышенным риском онкологических заболеваний, которые он может передать своим детям.
- Составить «молекулярно-генетический портрет» опухоли и выяснить, к каким препаратам она чувствительна.
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания.
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально.
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик.
Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Протоонкогены кодируют белки, активирующие деление клеток. В норме они должны «включаться» лишь в определенное время. Если в протоонкогене возникает мутация, либо он становится чрезмерно активным (например, из-за увеличения количества копий), он превращается в онкоген, и нормальная клетка становится опухолевой.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Гены-супрессоры опухолей ограничивают размножение клеток, восстанавливают поврежденную ДНК, отвечают за «смерть» отработавших своё клеток.
Рак возникает из-за того, что в результате мутаций эти гены перестают справляться со своей функцией. Например, гены BRCA1 и BRCA2 отвечают за репарацию ДНК.
При наследственных мутациях в них у женщин повышен риск того, что будет диагностирован рак молочной железы, яичников.Европейская клиника сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
- замену оснований — «букв» генетического кода;
- делеции — утрату участка хромосомы;
- инсерции — «лишние» вставки ДНК в хромосомах;
- изменение числа копий определенного гена;
- фьюжн-мутации — слияние генов, в результате которого образуется новый, гибридный ген;
- микросателлитную нестабильность;
- мутационную нагрузку опухоли.
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением.
Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево.
Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
Если речь идет о наследственных мутациях, для анализа достаточно сдать кровь из вены. Для составления «молекулярно-генетического портрета» рака чаще всего нужен биоптат — образец ткани злокачественной опухоли. Существует и более современная методика — жидкостная биопсия, когда исследуют ДНК опухолевых клеток, циркулирующую в крови.
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.
Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком.
Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения.
Генетические исследования на рак в Европейской клинике
В Европейской клинике есть всё для того, чтобы, при необходимости, назначить онкологическому пациенту персонализированную терапию, замедлить прогрессирование болезни и продлить жизнь.
Мы применяем все препараты последних поколений, зарегистрированные на территории России, и сотрудничаем с ведущими европейскими, американскими лабораториями, которые проводят генетические исследования в онкологии.
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
Записьна консультациюкруглосуточно+7 (495) 151-14-538 800 100 14 98
Источник: https://www.euroonco.ru/patcientam/geneticheskiy-analiz-na-rak
Соматические мутации генов BRCA1 и BRCA2
Режим работы в праздничные дни
с 01.05 по 11.05 — сокращённый график:
с 1 по 5 мая – выходные дни, лаборатория не работает.
с 6 по 8 мая — работаем по обычному расписанию.
с 9 по 11 мая — выходные дни, лаборатория не работет.
Центр Инновационных Биотехнологий Аллель предлагает комплекс исследований для выявления мутаций в генах у пациентов с раковыми заболеваниями. Узнайте о наличии изменений в ДНК для назначения лечения.
Гены BRCA1 и BRCA2 ответственны за исправление повреждений ДНК. Диагностика изменений этих генов важна в определении тактики лечения, а также при прогнозировании течения заболевания.
Наиболее частыми последствиями изменения нуклеотидной последовательности генов BRCA1 и BRCA2 является рак молочной железы у мужчин и женщин, опухоли яичников, простаты и других органов.
Раковые болезни, при которых обнаруживаются генетические маркеры BRCA, характеризуются высокой степенью злокачественности и выраженной лимфоидной инфильтрацией.
Пройдите тест на соматические мутации в лаборатории, чтобы получить релевантное лечение и проверить его эффективность. Получите ответы на интересующие вопросы, записавшись на консультацию с помощью специальной формы внизу страницы.
Что необходимо знать о мутации генов в онкологии
Рак является заболеванием, которое возникает вследствие мутации генов. Одной из причин возникновения опухолей разных тканей является наследование измененных участков ДНК (герминальные мутации).
Генетический материал с неправильной нуклеотидной последовательностью передается к человеку на стадии формирования половых клеток в организме родителей при делении клеток.
Однако наличие генетических изменений, унаследованных от родственников, не является гарантией проявления болезни, хотя и повышает риск появления онкологии.
В отличие от герминальных мутаций, соматические мутации возникают в течение жизни (не наследуются от родителей к детям) в различных тканях и органах и могут стать причиной возникновения онкологических заболеваний. Факторы повреждения молекул ДНК:
- физические факторы ‒ все виды радиации, ультрафиолетовое излучение, СВЧ, температура.;
- химические факторы ‒ различные компоненты табачного дыма (полициклические и гетероциклические ароматические углеводороды, ароматические амины, альдегиды), мутагены (нитрозогуанидин и этилметансульфонат и др.), уретан, формальдегид, азотистая кислота и др.;
- биологические факторы ‒ афлатоксин и другие эндо- и экзотоксины, активные формы кислорода.
Соматические изменения являются причиной возникновения рака практически в 90% случаев.
Анализ на мутации генов при онкологии
Соматические мутации генов BRCA выявляются в 6-8% случаев серозного рака яичника высокой степени злокачественности и составляют не менее 20% случаев BRCA-ассоциированного рака яичника.
Онкогенетический тест на мутации в генах BRCA1 и BRCA2 может проводится для пациентов с диагностированным раком молочной железы и/или яичников. Задача такого исследования – подбор таргетной терапии, воздействующей исключительно на поврежденные ткани. Также анализ позволяет определить целесообразность назначения химио- и радиотерапии и провести контроль эффективности лечения.
Мутации генов BRCA 1,2 рекомендуется исследовать одновременно в крови и в опухолевой ткани, Это позволяет с максимальной чувствительностью выявлять случаи отягченного рака и определять герминальный или соматический характер мутации у конкретного человека.
Взятие образцов венозной крови для исследования ДНК может производиться в любое время суток, прием пищи или специальная диета не повлияют на результат.Опухолевая ткань также является предметом исследования. Анализ атипичных клеток позволяет с большой долей вероятности определить тип генетических нарушений и подобрать релевантную терапию.
Оценка результатов исследования
Современные способы исследования практически полностью автоматизированы, что уменьшает количество ложных результатов. Все изменения в генетическом материале при анализе крови или опухолевой ткани фиксируют приборы.
Расшифровка анализов проводится специалистом, который наблюдает пациента. Самостоятельные выводы, сделанные на основе данных, могут быть неверны.
При определении BRCA-ассоциированного рака, врач меняет тактику лечения пациента.
Для улучшения качества жизни пациентов и увеличения ее продолжительности, снижения риска рецидивов и возникновения метастазов рекомендуется регулярно контролировать успешность лечения. Персонализированная терапия позволяет повысить эффективность лекарственных и других средств, и в некоторых случаях полностью избавиться от недуга.
Как записаться на генетический анализ BRCA1 и BRCA2
Центр Инновационных Биотехнологий Аллель предлагает различные виды исследования генных мутаций. Узнайте, какой анализ необходимо сдать у специалиста. Запишитесь на консультацию врача-генетика на сайте или по телефону:+7 (495) 780-92-96.
Консультация врача-генетика для назначения исследования
Источник: https://AllelTech.com/shop/catalog/onkogenetika/vyyavlenie-somaticheskikh-mutatsiy-v-obraztsakh-opukholevoy-tkani-parafinovye-bloki-gistologicheskie/somaticheskie-mutatsii-genov-brca1-i-brca2/
Анализ на генетику при беременности — что показывает и зачем нужен
Во время генетического анализа специалисты-генетики изучают гены, которые отвечают за передачу наследственных данных от родителей ребенку. Они рассчитывают вероятный результат зачатия, определяют доминантные признаки плода, а также возможные заболевания с пороками развития.
Идеальным вариантом считается обращение к генетику на этапе планирования беременности.
Что показывает генетический анализ при беременности
Анализ на генетику при беременности проводится, чтобы вы могли узнать информацию:
- обладают ли будущие родители генетической совместимостью;
- риск наследственной предрасположенности малыша к определенным болезням;
- имеются ли у матери и ребенка инфекционные возбудители;
- генетический паспорт лица, где находится комбинированный анализ ДНК, отражающий сведения о неповторимости конкретного лица.
Перечисленные данные помогут предупредить нарушения со здоровьем малыша.
Отдельное внимание следует уделить генетическому обследованию при замершей беременности. Иногда именно из-за врожденной тромбофилии случается многократное невынашивание ребенка.
Повторные случаи неразвивающегося плодного яйца у женщины – повод отправить материал на определение кариотипа с хромосомным набором эмбриона.
Специалист может исследовать содержание у беременной ИЛ-4: при замирании плода уровень цитокинов снижен.
Зачем и на каком сроке сдавать анализ
После возникновения хромосомной мутации изменяется структура молекулы ДНК, формируется плод с тяжелейшими аномалиями. Чтобы предотвратить патологию, врачи рекомендуют планировать беременность с проведением генетических тестов, демонстрирующих почти 100% точность подтверждения нарушений развития плода.
Для оценки внутриутробного развития специалисты проводят ультразвуковую диагностику и биохимический тест. Они не представляют никакой угрозы для здоровья или жизни малыша.
Первое УЗИ беременная проходит на сроке 10-14 недель, второе – 20-24 недели. Врач обнаруживает даже незначительные дефекты крохи.
На 10-13 и 16-20 недель будущие мамы сдают генетическую двойку: так называется анализ крови на ХГЧ и РАРР-А.
Если после применения перечисленных методов специалист выявляет патологию развития, назначаются инвазивные тесты.
Они выполняются в следующие периоды гестации:
- Биопсия хориона: на сроке 10-12 недель.
- Амниоцентез: 15-18 недель.
- Плацентоцентез: 16-20 недель.
- Кордоцентез: по завершении 18 недель.
Показания к проведению анализа
Выполнение генетического теста обязательно, если беременная включается в группу риска:
- будущая мама превышает 35-летний возраст;
- у будущей мамы уже рождались дети с врожденными аномалиями или отклонениями;
- в предыдущей беременности женщина перенесла опасные инфекции;
- наличие продолжительного времени алкогольной или наркотической зависимости перед наступлением оплодотворения;
- наличие случаев самопроизвольного выкидыша или мертворождения.
Группа повышенного риска
Существует определенная категория дам, которым показана обязательная консультация генетика:
- Будущая мама не достигла 18 лет или возраст превысил 35 лет.
- Наличие болезней наследственного характера.
- Женщины, родившие ребенка с аномалиями развития.
- Имеющие в прошлом или нынешнее время любой вид зависимости – алкогольной, наркотический, табачной.
- Пары, страдающие опасными инфекциями – ВИЧ, гепатит, беременные перенесшие краснуху, ветрянку, герпес на начальных сроках гестации.
- Будущая мама, которая принимала лекарственные средства, нежелательные для применения во время вынашивания ребенка.
- Получившие дозу облучения в начале гестации из-за прохождения флюорографии или рентгенологического обследования.
- Занимавшиеся в молодые годы экстремальным спортом женщины.
- Будущие мамы, принявшие высокую дозу УФ-облучения.
Иногда женщина не знает о произошедшем зачатии, подвергаясь действию неблагоприятных факторов. Поэтому риск попадания в группу риска появляется у многих беременных.
Подготовительные меры
Как подготовиться? Перед сдачей крови постарайтесь с утра не есть или пройдите тест по прошествии 5 часов после еды.
Для подготовки к УЗИ абдоминальным методом за 30 минут до исследования выпейте пол-литра обычной воды, чтобы наполнить мочевой пузырь. За 1-2 дня придерживайтесь диеты.
Откажитесь от употребления продуктов, вызывающих брожение: капуста, виноград, черный хлеб, газированные напитки.Если потребуется провести вагинальное обследование, заранее примите душ, а перед процедурой опорожните мочевой пузырь.
Как делают генетический анализ — методы проведения исследований
Генетик подробно изучает родословную будущих родителей, оценивает риск наследственных заболеваний. Специалист учитывает профессиональную сферу, экологические условия, влияние лекарственных средств, принимаемых незадолго до визита к доктору.
Врач проводит исследование кариотипа, который необходим для будущей мамы с отягощенным анамнезом. Оно дает возможность проанализировать качественный и количественный хромосомный состав женщины. Если родители – близкие кровные родственники или случалось невынашивание беременности, необходимо провести HLA-типирование.
Генетик проводит неинвазивные методы диагностики врожденных аномалий развития плода – УЗИ и тесты на биохимические маркеры.
К последним относятся:
- определение содержания ХГЧ;
- анализ крови на РАРР-А.
Американской компанией был запатентован еще 1 тест. На 9 неделе будущая мама сдает венозную кровь, где содержится наследственная информация – ДНК ребенка. Специалисты подсчитывают число хромосом, а при наличии патологии выявляются ряд синдромов – Дауна, Эдварса, Патау, Тернера, Ангельмана.
Если неинвазивные исследования обнаруживают аномалии, специалист проводит инвазивное обследование. С их помощью осуществляют забор материала, определяют с высокой точностью кариотип малыша для исключения наследственной патологии – синдрома Дауна, Эдварда.
К таким методам относятся:
- Биопсия хориона. Врач проводит прокол передней брюшной стенки, а затем берет клетки формирующейся плаценты.
- Амниоцентез. Берут пункцию амниотической жидкости, оценивают ее цвет, прозрачность, клеточный и биохимический состав, объем, уровень гормонов. Процедура считается наиболее безопасной из инвазивных диагностических методов, но требует немало времени для получения заключения. Обследование выявляет аномалии, появившиеся во время беременности, оценивает уровень развития плода.
- Кордоцентез. Исследование заключается в проведении пункции пуповины с забором крови ребенка. Метод является точным, а результаты становятся известны через несколько дней.
- Плацентоцентез. Осуществляется анализ плацентарных клеток.
В результате проведенных тестов специалист составляет для родителей генетический прогноз. На его основании можно предугадать вероятность появления врожденных патологий у малыша, наследственных заболеваний. Врач разрабатывает рекомендации, помогающие планировать нормальную беременность, а если зачатие уже произошло, определяет, стоит ли ее сохранять.
АзбукаРодов советуют: Подписывайтесь на наш канал
Источник: https://zen.yandex.ru/media/id/5b2379347ddde8d1ca77d255/5b23bd6a86114e00ac88c54a
BRAF-мутация при меланоме (БРАФ): что это, кому нужен анализ, подготовка, расшифровка результата

Ген BRAF участвует в делении клеток. В норме этот процесс также регулируют гормоны и факторы роста. Но в случае мутации такого гена происходит сбой, что провоцирует образование раковых клеток. В основном такие изменения характерны для меланомы. Но возможна и мутация в гене BRAF при других видах рака.
Что такое мутация в гене BRAF
Развитие злокачественных новообразований в основном происходит из-за сбоя в так называемых сигнальных путях. Под последними понимается цепочка, по которой проходит импульс от рецептора к ядру клетки.
К числу подобных сигнальных путей относится МАРК. Импульсы, поступающие от факторов роста и гормонов, принимаются и «ретранслируются» рецептором. Приведенный процесс описывает особенности клеточного деления.
В случае точечной мутации в гене BRAF, обладающего большей активностью среди всех белков, составляющих МАРК, нарушается передача сигналов по данному пути. Причины, вызывающие подобные изменения, пока не установлены. Из-за таких мутаций белок BRAF приобретает способность самостоятельно активировать сигнальный путь, вследствие чего клетки начинают бесконтрольно делиться.
Такая мутация характерна для следующих видов рака:
- меланома;
- папиллярный рак щитовидной железы;
- немелкоклеточный рак легкого;
- рак предстательной железы;
- колоректальный рак.
Открытие BRAF-мутации позволило найти новые препараты для лечения раковых опухолей. Эти лекарства блокируют передачу импульсов по сигнальным путям, за счет чего приостанавливается развитие злокачественного новообразования.
Кому нужно сдать анализ на определение мутации
Анализ BRAF-мутации назначается на третьей и четвертой стадиях развития указанных видов рака. Также это исследование рекомендуют проводить в случаях, когда выявляются злокачественные новообразования на начальных этапах при условии, что опухоль растет быстро.
Зачем нужно проводить анализ
Анализ на BRAF-мутацию при меланоме или других формах злокачественных опухолей проводится для того, чтобы установить истинную причину перерождения клеток.
Такое исследование помогает подобрать таргетную терапию, которая воздействует непосредственно на злокачественную опухоль, приостанавливая развитие последней.
Этот подход снижает вероятность возникновение сопутствующих заболеваний, появление которых обусловлено приемом лекарственных препаратов.
Также анализ на мутацию необходим потому, что неправильно подобранное лечение способно ускорить развитие опухолевого процесса и сократить продолжительность жизни пациента.
Подготовка
Специальной подготовки к анализу на BRAF-мутацию не требуется. Объясняется это тем, что для исследования проводится забор тканей непосредственно из злокачественной опухоли.
Как берут
Для определения мутаций при меланоме потребуется материал, состоящий не менее чем на 20% из перерожденных клеток. Обычно такой биоптат получают в ходе удаления злокачественной опухоли, которую сразу после операции отправляют в лабораторию.
Забранный материал помещается в формалин, а затем — в парафиновые блоки. Перед началом исследования из биоптата делается забор небольшого количества тканей для экстракции ДНК. После этого приступают к анализу материала.
Исследование на BRAF-мутацию проводится с помощью аллель-специфической полимеразно цепной реакции (ПЦР) либо секвентирования ДНК. Для каждой из указанных процедур потребуется небольшой кусок ткани, взятой из зоны поражения.
Материал забирается в рамках хирургического вмешательства по поводу злокачественной опухоли или в ходе биопсии. В каждом из случаев врач отрезает и отправляет на гистологическое исследование кусок ткани. В качестве биоптата также используют и метастазные образования.Аллель-специфическая ПЦР считается более эффективным методом выявления мутации. Этот способ позволяет с высокой точностью определить наличие изменений. Однако с помощью аллель-специфической ПЦР удается выявить мутацию только в одном гене. Чтобы воссоздать полную картину произошедших изменений, к этой процедуре приходится прибегать повторно.
Выявить точную последовательность мутаций помогает секвентирование ДНК. Для этого анализа также проводится забор тканей из опухоли. Основной недостаток такого метода заключается в том, что в 2-10% случаев секвентирование дает ложноположительный результат. Кроме того, это исследование проводится на дорогостоящем оборудовании, в связи с чем при диагностировании меланомы чаще применяют ПЦР.
Что может исказить результат
Метод секвентированя ДНК в ряде случаев дает ложноположительный результат. К этому приводят ошибки при заборе и транспортировке биоптата, что вызывает деградацию материала.
Расшифровка результата
Результаты анализа на BRAF-мутацию может быть положительным либо отрицательным. То есть это исследование не позволяет определить тип злокачественной опухоли, локализацию и стадию развития новообразования. Поэтому такой метод применяется после того, как был диагностирован рак.
Анализ на мутацию гена BRAF позволяет отличить следующие формы опухолей:
- папиллярную от других подобных новообразований и доброкачественных узлов, локализующихся в щитовидной железе;
- спорадическую от неполипозной колоректальной в толстой кишке;
- волосатоклеточный лейкоз от других B-клеточных лимфом.
Кроме того, результаты исследования помогают составить примерный прогноз развития опухоли. Большинство новообразований, вызванных мутацией гена BRAF, характеризуются агрессивным ростом. Также это исследование позволяет своевременно исключить из медикаментозной терапии ряд препаратов, которые стимулируют развитие злокачественных опухолей.
Источник: https://onkologia.ru/diagnostika/prochie-metody-diagnostiki/braf-mutatsiya/
